
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA
B.4.2 g C3H6中含有的碳碳双键数一定为0.1 NA
C.1 mol﹣OH中电子数为10 NA
D.标准状况下,2.24 L CHCl3的原子总数为0.1 NA
科目:高中化学 来源: 题型:
【题目】既可以鉴别乙烷和乙烯,又可以除去乙烷中混有的乙烯,得到纯净乙烷的方法是
A. 与足量Cl2反应 B. 通入足量溴水中
C. 在一定条件下通入氢气 D. 通入足量高锰酸钾溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发清洁能源是当今研究的热点问题.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3 . 工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)CH3OH(g)△H1=﹣99kJmol﹣1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
(1)催化反应室中的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),计算△H= . 反应原料来自煤的气化.已知该反应的平衡常数表达式为K= ![]() ,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式 .
,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式 .
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6molL﹣1 , c(H2)=1.4molL﹣1 , 8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为 .
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(molL﹣1) | 0.46 | 1.0 | 1.0 |
此时刻v正v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是 .
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图1所示,图中X代表(填“温度”或“压强”)判断的理由是 
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比 ![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( ) 
A.芥子醇的分子式是C11H12O4
B.芥子醇分子中所有碳原子可能在同一平面
C.1mol芥子醇能与足量溴水反应消耗3molBr2
D.1mol芥子醇与足量的氢气反应消耗氢气4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图示意铝在氧气中燃烧的实验,铝条点燃后,为维持燃烧继续,正确的操作是( ) 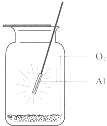
A.铝条应始终置于集气瓶瓶口位置
B.迅速将铝条插入集气瓶接近瓶底位置
C.将铝条从瓶口位置慢慢伸向瓶底位置
D.铝条应不断上下移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示.则:
(1)写出OA段发生反应的离子方程式:OA段 ,图中线段OP:PB= .
(2)计算原AlCl3溶液的物质的量浓度为 mol/L
(3)图中A对应的横坐标为 mL
(4)当加入5ml NaOH溶液时,产生沉淀量为 mol.
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语中,正确的是( )
A. 次氯酸的结构式:H—O—Cl
B. 氮气的电子式:∶N∶∶∶N∶
C. CO2分子的电子式:O=C=O
D. 用电子式表示氯化氢分子的形成过程:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质.利用拜耳法生产氧化铝的流程如图所示: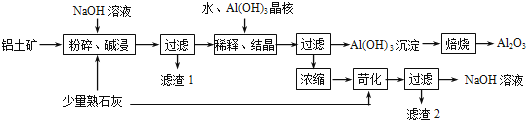
(1)粉碎后的铝土矿碱浸时应在高温下进行,其目的是 .
(2)AlO(OH)与NaOH反应的化学方程式为 .
(3)在稀释、结晶过程中:稀释的目的是 ;加Al(OH)3晶核的目的是促进Al(OH)3的析出.上述“稀释、结晶”工艺,也可用通入足量的 气体的方法来代替.
(4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式: .
(5)该生产流程能实现 (填化学式)的循环利用.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知25.0 mL 0.100 mol·L-1 Na2S2O3溶液恰好把224 mL Cl2(标准状况下)完全转化为Cl-,则S2O32-将转化为( )
A. SO42- B. S C. SO32- D. S2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com