
����Ŀ��ij����������Ҫ����Al2O3��Al��OH��3��AlO��OH����������Fe2O3�����ʣ����ðݶ���������������������ͼ��ʾ��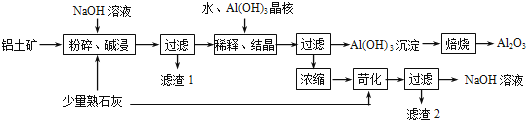
��1����������������ʱӦ�ڸ����½��У���Ŀ���� ��
��2��AlO��OH����NaOH��Ӧ�Ļ�ѧ����ʽΪ�� ��
��3����ϡ�͡��ᾧ�����У�ϡ�͵�Ŀ���� ����Al��OH��3���˵�Ŀ���Ǵٽ�Al��OH��3��������������ϡ�͡��ᾧ�����գ�Ҳ����ͨ�������� ����ķ��������森
��4��Ũ�����õ�NaOH��Һ���������˿����е�CO2���������ʣ������ʿ�ͨ��������Ӧ��ȥ��д��������Ӧ�Ļ�ѧ����ʽ���� ��
��5��������������ʵ�� ���ѧʽ����ѭ�����ã�
���𰸡��ӿ췴Ӧ�����ʣ�AlO��OH��+NaOH=NaAlO2+H2O���ٽ�NaAlO2��ˮ�⣻CO2��Na2CO3+Ca��OH��2=CaCO3��+2NaOH��NaOH
����������1����1����������������ʱӦ�ڸ����½��У��¶�Խ�߷�Ӧ�ٶ�Խ�죬���Դ��ǣ��ӿ췴Ӧ�����ʣ�
��2��AlO��OH����NaOH��Ӧ�����õ�ƫ�����ƣ��ƺ���֮��Ϊ1��1�����ԣ�AlO��OH����NaOH��1��1��Ӧ����AlO��OH��+NaOH=NaAlO2+H2O��
���Դ��ǣ�AlO��OH��+NaOH=NaAlO2+H2O��
��3��ԽϡԽˮ�⣬��ˮϡ�ʹٽ�ƫ��������ӵ�ˮ�⣬Ҳ������ƫ�������������̼���巴Ӧ�Ƶã����Դ��ǣ��ٽ�NaAlO2��ˮ�⣻CO2��
��4��Ũ�����õ�NaOH��Һ���������˿����е�CO2���������ʣ�������̼���ƣ�̼�������������Ʒ�Ӧ���ɿ����ƣ��Ӷ���ȥ̼������ӣ�����ʽΪNa2CO3+Ca��OH��2=CaCO3��+2NaOH�����Դ��ǣ�Na2CO3+Ca��OH��2=CaCO3��+2NaOH��
��5��������Ӧ�������������ƣ���ǰ���������������ܽ�����������������ʵ�ֵ�ѭ��������NaOH�����Դ��ǣ�NaOH��


 ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ڼ�����Һ�пɷ������·�Ӧ��2R(OH)3 + 3C1O- + 4OH�� = 2RO4n-+3Cl�� +5H2O����RO4n-��R �Ļ��ϼ���
A. +3 B. +4 C. +5 D. +6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������������ȷ���ǣ� ��
A.���³�ѹ�£�28 g��ϩ�ͻ����飨C4H8���Ļ�������к��е�̼ԭ����Ϊ2 NA
B.4.2 g C3H6�к��е�̼̼˫����һ��Ϊ0.1 NA
C.1 mol��OH�е�����Ϊ10 NA
D.��״���£�2.24 L CHCl3��ԭ������Ϊ0.1 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����![]() H��
H��![]() H��
H��![]() H��
H��![]() Mg��
Mg��![]() Mg��
Mg��![]() Cu�й���______��Ԫ�أ�______��ԭ�ӡ�
Cu�й���______��Ԫ�أ�______��ԭ�ӡ�
��2���ڢ�CaCl2����KOH����He����H2SO4����Na2O2����I2�����������Ӽ�����_______��������������м��Թ��ۼ�����________�����������
��3�����ӱ����õ�ij��ť�۵�صĵ缫����ΪZn��Ag2O���������ҺΪKOH����缫��ӦʽΪ��Zn��2OH����2e����ZnO��H2O �� Ag2O��H2O��2e����2Ag��2OH��
��صĸ�����_____��д�缫���ţ���������������____________��Ӧ(�Ӧ����)���ܷ�ӦʽΪ___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaOH��AlCl3��MgCl2���ֹ�����ɵĻ�����������ˮ�к���0.58�˰�ɫ��������������Һ�У���μ���0.5mol/L�����ᣬ�����������������ɳ�����������ϵ��ͼ��ʾ��
��1���������NaOH�����ʵ���Ϊ�� ��
��2���������AlCl3������ ��
��3���������MgCl2������ ����
��4��P���ʾ���������� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ksp��AgCl��=1.8��10��10 �� Ksp��AgI��=1.5��10��16 �� Ksp��Ag2CrO4��=2.0��10��12 �� �����������εı�����Һ�У�Ag+Ũ�ȴ�С˳����ȷ���ǣ� ��
A.AgCl��AgI��Ag2CrO4
B.AgCl��Ag2CrO4��AgI
C.Ag2CrO4��AgCl��AgI
D.Ag2CrO4��AgI��AgCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӷ���ʽBaCO3+2H+=CO2��+H2O+Ba2+�е�H+�������������������е���
��HCl ��H2SO4 ��HNO3 ��NaHSO4 ��H2CO3
A. �٢� B. �٢ܢ� C. �ڢܢ� D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ȼҵ�е�ⱥ��ʳ��ˮ��ԭ��ʾ��ͼ����ͼ��ʾ��

��ҺA������������__________����ⱥ��ʳ��ˮ�����ӷ���ʽΪ___________��
��2��������һ�������Դ����������ȡ�봢��������Դ����������о��ȵ㡣
��֪��CH4(g)��H2O(g)��CO(g)��3H2(g) ��H��+206.2 kJ/mol
CH4(g)��CO2(g)��2CO(g)��2H2(g) ��H��+247.4 kJ/mol
�Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ����CH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪ_________________��
��3����������������ѧ��Fulvio Cacace���˻���˼��������о������N4���ӡ�N4���ӽṹ��ͼ����֪����1mol N��N����167kJ����������1mol N��N�ų�942kJ����������������Ϣ�����ݣ�����N2��������1mol��̬N4�ġ�H=_____kJ/mol��

��4����COΪȼ����������ȼ�ϵ�أ���ص�����ͨ��O2��CO2������ͨ��CO�������������Na2CO3�����ظ����缫��ӦʽΪ_______________�������ĵ缫��ӦʽΪ ____________���ŵ�ʱ��CO32�� �����ص�_______(���������)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʾ�Ϊ�������ʻ����ǵ���Һ������AΪ����ɫ������C��X��Ϊ��ɫ������ZΪdz��ɫ��Һ��DΪһ�ֳ�����ǿ����
��������֮���ת����ϵ����ͼ�����û�ѧ����ش����⣺�����ֲ�����ʡ�ԣ�

��1��д���������ʵĻ�ѧʽ��A_____________ B ___________ D _____________
��2��A��SO3(g)�ķ�Ӧ������A��X�ķ�Ӧ����д��A��SO3(g)��Ӧ�Ļ�ѧ����ʽΪ��______________________________________________________________________________��
��3����Z��Һ��ͨ��һ������Cl2��д������Z���������Ƿ�Ӧ��ȫ�����Լ���__________��
��4������Eת��Ϊ����F������Ϊ____________________________________________________����ѧ����ʽΪ��_______________________________________________________________________��
��5����10g D����Һ��ͨ��һ������X������D��ȫ��Ӧ���ڵ��������������ᾧ�����յõ�14.8g���塣�ټ��������ᾧ�ڵ��������½��е����ɣ�_________________________________��
�����ù����к��е�����Ϊ__________________ �����ǵ����ʵ���֮��Ϊ__________________����������Ϊ��һ���ʣ�����˿գ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com