
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板a和b分成甲、乙两室.标准状况下,在乙室中充入0.6molHCl,甲室中充入NH3、H2的混合气体,静止时活塞位置下图.已知甲、乙两室中气体的质量之差为10.9g.
请回答下列问题:
(1)甲室中气体的物质的量为mol.
(2)甲室中气体的质量为g.
(3)甲室中NH3、H2的物质的量之比为 , 质量比为 .
(4)经过查资料知道HCl+NH3=NH4Cl(NH4Cl常温下是固体),如果将板a去掉,当HCl与NH3完全反应后,活塞b将静置于刻度“”处(填数字).
【答案】
(1)1.0
(2)11.0
(3)3:2;51:4
(4)2
【解析】解:(1)相同条件下,气体的物质的量之比等于其体积之比,看图可知甲、乙两室气体的体积比为5:3,故其物质的量之比为5:3,所以甲室中气体为1.0mol,所以答案是:1.0;(2)HCl气体的质量为0.6mol×36.5g/mol=21.9g,则甲室中气体的质量为21.9g﹣10.9g=11.0g,所以答案是:11.0;(3)设氨气的物质的量为x,氢气的物质的量为y,根据其物质的量、质量列方程组为: ![]() ,
, ![]() 所以氨气和氢气的物质的量之比=0.6mol:0.4mol=3:2,其质量之比=(0.6mol×17g/mol):(0.4mol×2g/mol)=51:4,所以答案是:3:2;51:4;(4)甲室中NH3的物质的量为1.0mol×3/5=0.6mol,恰好等于HCl的物质的量,所以二者恰好完全反应生成NH4Cl固体,剩余H2的物质的量为0.4mol,相同条件下,气体的体积之比等于其物质的量之比,所以活塞b将会左移至“2”处,所以答案是:2.
所以氨气和氢气的物质的量之比=0.6mol:0.4mol=3:2,其质量之比=(0.6mol×17g/mol):(0.4mol×2g/mol)=51:4,所以答案是:3:2;51:4;(4)甲室中NH3的物质的量为1.0mol×3/5=0.6mol,恰好等于HCl的物质的量,所以二者恰好完全反应生成NH4Cl固体,剩余H2的物质的量为0.4mol,相同条件下,气体的体积之比等于其物质的量之比,所以活塞b将会左移至“2”处,所以答案是:2.


科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P-P:a kJ·mol-1、P—O:b kJ·mol-1、P===O:c kJ·mol-1、O===O:d kJ·mol-1。根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A. (6a+5d-4c-12b) kJ·mol-1
B. (4c+12b-6a-5d) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1
D. (4a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,在350℃时会迅速分解生成CaO和O2 , 杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面,其工业生产流程如下:
(1)步骤②制取CaO28H2O的反应(填“属于”或“不属于”)氧化还原反应.
(2)该流程中可循环使用的物质是 .
(3)检验CaO28H2O是否洗净的方法是 .
(4)在CaO28H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是抑制CaO2分解和 .
(5)实验室用如图所示装置测定产品中CaO2的含量(加热、夹持、连接管等仪器省略).
①装置连接的顺序为(填字母);A中药品为 .
②写出实验开始前检验装置的气密性的方法: .
③若所取产品的质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为(用含m、V的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K= ![]() .有关该平衡体系的说法正确的是( )
.有关该平衡体系的说法正确的是( )
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当运动员肌肉挫伤或扭伤时,队医随即对准运动员的受伤部位喷射药剂氯乙烷(沸点为12.27℃)进行局部冷冻麻醉应急处理。下列关于氯乙烷的说法中不正确的是( )
A.氯乙烷与水互不相溶
B.氯乙烷中含有两种官能团
C.氯乙烷在一定条件下能发生消去反应
D.氯乙烷的结构只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电的锂离子电池,以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池总反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e- =Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e- =Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入2 mol SO3(g),关闭K,向B容器中充入1 mol SO3(g),两容器分别发生反应:2SO3(g) ![]() 2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
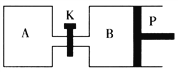
(1)反应达到平衡时容器B的体积变为1.2aL,容器B中SO3转化率为___________。
(2)若打开K,一段时间后重新达到平衡,容器B的体积为___________L(连通管中气体体积忽略不计)。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)![]() CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
Ⅲ | 900 | 2 | 1 | a | b | t |
①由表中数据可知该反应的△H_______ 0(填“>”或“<”)。
②实验Ⅲ中a=______,达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:α2(H2O)____α3(H2O)(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com