
【题目】碳及其化合物在人们的日常生活、工农业生产及科学研究中有着重要的作用。回答下列有关问题:
(1)煤炭是人们利用最为广泛的燃料,但因煤炭含硫而导致大气污染。对燃煤烟气中的SO2可采用碳酸钙浆液法吸收,即把燃煤烟气和空气同时鼓入到含CaCO3的浆液中,使SO2被吸收。①该反应生成石膏(CaSO4 2H2O),化学方程式为____________________。
②标准状况下,某种烟气中SO2含量为2.1×10-3g L-1,则反应中转移3 mol电子时,处理标
准状况下烟气的体积为___________L(保留两位有效数字)。
(2)工业炼铁的基本原理是:在高温下,焦炭燃烧生成的CO将铁矿石中铁的氧化物还原得到铁。
已知:
①Fe2O3(s)+3C(s,石墨)==2Fe(s)+3CO(g) △H= +489.0 kJ mol-1;
②C(s,石墨)+CO2(g) ==2CO(g) △H= +172.5 kJ mol-1。
则CO还原Fe2O3(s)的热化学方程式为_______________________。
(3)碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料。一定温度时,在容积为1.0 L的恒容密闭容器中充入2.5molCH3OH(g)、适量CO2和5×10-3催化剂,容器中发生反应:2CH3OH(g) +CO2(g) ![]() CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:
CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:

已知:TON=![]()
①该温度时,甲醇的最高转化率为_______________。
② 0 ~7 h内DMC的平均反应速率是_______mol·L-1·h-1(保留两位有效数字)。
③图2是甲醇转化数随某种物理量的变化曲线,该物理量可能是_______;为使该反应向正
反应方向移动,可采取的措施有______________________。(答出一条即可)。
(4)CO2溶解于水形成碳酸。碳酸与次氯酸的电离常数如下表所示:
弱酸 | 碳酸 | 次氯酸 |
电离常数(Ka) | Ka1=4.4×l0-7 Ka2=5.6×10-11 | 3.0×10-8 |
在NaClO溶液中通入少量CO2 ,反应的离子方程式为_____________________,0.03 mol L-1 NaClO 溶液的 pH=________________。
【答案】 2CaCO3+2SO2+O2+4H2O==2(CaSO42H2O) +2CO2 4.6×104 Fe2O3(s)+3CO(g)==2Fe(s)+3CO2(g) △H=-28.5 kJ mol-1 7% 0.011 温度 降温、增大CH3OH或CO2浓度、抽走DMC或水蒸气等 CO2+ClO-+H2O==HClO + HCO3- 10
【解析】(1)①本题考查化学反应方程式的书写,亚硫酸的酸性强于碳酸,氧气把+4价S氧化成+6价,CaCO3+SO2+O2+H2O→CaSO4·2H2O+CO2,根据化合价的升降法进行配平,即 2CaCO3+2SO2+O2+4H2O=2(CaSO4·2H2O) +2CO2;②本题考查化学计算,根据化学反应方程式,消耗2molSO2时,转移电子为2×2mol=4mol,现在转移3mol电子,消耗SO2的物质的量为2×3/4mol=1.5mol,其中SO2的质量为1.5×64g=96g,因此烟气的体积为96/2.1×10-3L=4.6×104L;(2)本题考查盖斯定律的应用,目标反应是:Fe2O3+3CO=2Fe+3CO2,①-②×3,得出:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=(489.0-3×172.5)kJ·mol-1=-28.5kJ·mol-1;(3)本题考查化学反应速率的计算、影响化学反应速率和化学平衡移动的因素,①甲醇的最高转化率是在10h,此时已转化甲醇的物质的量为35×5×10-3mol=0.175mol,转化率为0.175/2.5×100%=7%;②0~7h时,甲醇转化的物质的量为30×5×10-3mol=0.15mol,生成DMC的物质的量为0.15/2mol=0.075mol,根据化学反应速率数学表达式,v(DMC)=0.075/(1×7)mol/(L·h)=0.011 mol/(L·h);③最高点时,达到平衡,然后随着反应进行,转化数降低,此反应的正反应是放热反应,因此升高温度,平衡向逆反应方向进行,转化数降低,因此是温度对甲醇转化数的影响,根据勒夏特列原理,降温、增大CH3OH或CO2浓度、抽走DMC或水蒸气等 ,促使反应向正反应方向进行;(4)本题考查电离平衡常数的影响以及pH的计算,电离平衡常数越大,说明电离程度越大,电离出H+能力大小:H2CO3>HClO>HCO3-,因此NaClO溶液通入少量CO2,发生CO2+ClO-+H2O=HClO+HCO3-;NaClO溶液中ClO-发生水解水解反应方程式为ClO-+H2O ![]() HClO+OH-,根据水解平衡常数的表达式,Kh=c(OH-)×c(HClO)/c(ClO-)=Kw/Ka,根据水解方程式,得出c(OH-)=c(HClO),水解的程度微弱,c(ClO-)=0.03mol·L-1,Kw=10-14,Ka=3.0×10-8,代入数值,求出c(OH-)=10-4mol·L-1,即pOH=4,pH=14-4=10。
HClO+OH-,根据水解平衡常数的表达式,Kh=c(OH-)×c(HClO)/c(ClO-)=Kw/Ka,根据水解方程式,得出c(OH-)=c(HClO),水解的程度微弱,c(ClO-)=0.03mol·L-1,Kw=10-14,Ka=3.0×10-8,代入数值,求出c(OH-)=10-4mol·L-1,即pOH=4,pH=14-4=10。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列叙述与图像对应符合的是
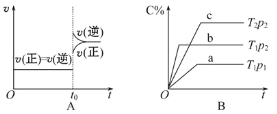

A.对于达到平衡状态的N2(g)+3H2(g) ![]() 2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动
2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动
B.p2>p1,T1>T2
C.该图像表示的化学方程式为:2A=B+3C
D.对于反应2X(g)+3Y(g) ![]() 2Z(g) ΔH<0,y可以表示Y的百分含量
2Z(g) ΔH<0,y可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.铜、石墨均导电,所以它们均是电解质
B.NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质
C.液态HC1、固体NaCl均不导电,所以HC1、NaCl均是非电解质
D.蔗糖、酒精在水溶液或熔融状态下均不导电,所以它们均是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人的血液呈________(填“酸性”、“弱酸性”、“中性”、“碱性”或“弱碱性”),我国居民形成了摄入蔬菜和水果偏少的习惯,一般尿液呈________性(填“偏酸”、“中性”或“偏碱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组粒子能在指定溶液中大量共存的是
A. 银氨溶液中:Na+、H+、NO3- B. 碘化钾溶液中:H+、H2O2、SO32-
C. 氢氧化钙溶液中:Na+、ClO-、HCO3- D. 偏铝酸钠溶液中:K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16O和18O是氧元素的两种核素,用NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
A.在18 g 16O2中含有NA个氧原子
B.16O与18O核外电子排布方式相同
C.在标准状况下,1.12 L 16O2和1.12 L 18O2均含有0.1NA个氧原子
D.18O2和16O2化学性质几乎相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com