
【题目】下列化合物中既能使溴的四氯化碳溶液褪色,又能在光照下与溴发生取代反应的是( )
A. 甲苯 B. 乙烷 C. 丙烯 D. 乙烯
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
【题目】根据所学知识完成下面题目:
(1)由于钠很容易与空气中的二氧化碳和等物质反应,所以钠在自然界里只能以态存在.
(2)维生素C又称为抗坏血酸,在人体内有重要的功能.例如帮助人体将食物中摄取的不易吸收的Fe3+变为易吸收的Fe2+ . 这说明维生素C具有(填氧化性或还原性).
(3)写出下列空格内物质的名称、俗名或化学式:
名称 | 氧化铁 | 碳酸钠 | 碳酸氢钠 |
俗名 | 铁红 | 小苏打 | |
化学式 | Na2CO3 | NaHCO3 |
(4)写出下列电离方程式或化学方程式:①Na2CO3在水溶液中的电离方程式②曾青(CuSO4)得铁化为铜的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中可能有下列阴离子中的一种或几种:SO![]() 、SO
、SO![]() 、S2-、CO
、S2-、CO![]() 、Cl-。
、Cl-。
①当溶液中有大量H+存在时,则不可能有存在。
②当溶液中有大量Ba2+存在时,则不可能有存在。
③当溶液中有和等阳离子存在时,上述所有阴离子都不可能存在。
④当向溶液中通入足量的Cl2时,离子在溶液中不可能存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中将4 mol气体A和2 mol气体B混合,在一定温度下发生反应:3A(g)+2B(g)xC(g)+2D(g).2min后达到平衡时生成1.6mol C,又测得反应速率v(D)=0.2mol/(Lmin),下列说法正确的是( )
A.x=4
B.B的转化率为60%
C.A的平衡浓度是2.8mol/L
D.平衡时气体的压强是原来的0.94倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化主要反应是煤中碳与水蒸气反应生成CO、H2等,回答下列问题:
(1)CO和H2分别与O2都可以设计成燃料电池,CO与O2设计成燃料电池(以熔融碳酸盐为电解质)负极的电极反应为
(2)在煤的气化获得的化工原料气中含有少量羰基硫(COS),能引起催化中毒、大气污染等,COS的电子式为羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为羰基硫的脱硫常用两种方法,其反应式分别为: ①氢解反应:COS(g)+H2(g)═H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如表
化学键 | C=O(CO2) | C=O(COS) | C=S | H﹣S | H﹣O |
键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
则△H2=kJ/mol
(3)脱硫处理后的CO和H2在催化剂作用下合成甲醇:CO2(g)+3H 2(g)CH3OH(g)+H2O(g)△H2=﹣90.14kJ/mol,该反应能自发的理由是 . ①一定温度下,在两个容积都为VL的恒容密闭容器中,找如下方式反应物,一段时间后达到平衡
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | mmolCO2、3mmolH2、 |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则n的取值范围为 , 反应的平衡常数K= .
②甲容器保持恒容,欲增大H2的平衡转化率,可采取的措施有(答两点即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( ) 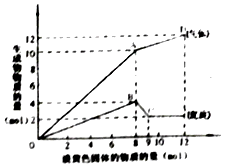
A.溶液中一定含有Mg2+、NH4+、Al3+ , 可能含有Fe2+
B.图中A点产生的气体总质量为230克
C.图中A到D之间会产生有刺激性气味的气体
D.图中B到C之间发生的化学反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgH2和Mg2Cu可用作贮氢材料,MgO可用作炉膛内脱硫脱硝的试剂.
(1)MgH2是一种离子化合物,其电子式为 .
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2 , 该反应的化学方程式为 .
(3)已知MgH2的有关热化学方程式如下: MgH2(s)Mg(s)+H2(g)△H1=+74.4 KJmol﹣1;
H2(g)+ ![]() O2(g)═H2O(g)△H2=﹣241.8 KJmol﹣1;
O2(g)═H2O(g)△H2=﹣241.8 KJmol﹣1;
Mg(s)+ ![]() O2(g)═MgO(s)△H3=﹣141.6 KJmol﹣1 .
O2(g)═MgO(s)△H3=﹣141.6 KJmol﹣1 .
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为 .
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为 . 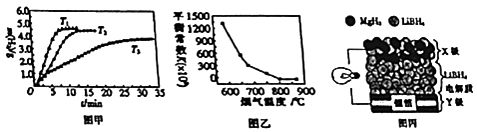
(4)炉膛内脱除SO2与NO的反应为2MgO(s)+2SO2 (g)+2NO(g)2MgSO4(s)+N2(g)△H=a KJmol﹣1 , 其平衡常数与温度的关系如图乙所示. ①上述反应的平衡常数表达式为K= .
②a(填“>”或“<”)0.
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2═Mg+2LiH.放电时,X极的电极反应式为 . 充电时,Y极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH标准溶液的配制和标定,需经过NaOH溶液配制,基准物质H2C2O42H2O的称量以及用NaOH溶液滴定等操作.下列有关说法正确的是( ) 
A.用图甲所示操作转移NaOH 溶液到容量瓶中
B.用图乙所示装置准确称得0.1575gH2C2O42H2O固体
C.用图丙所示操作检查碱式滴定管是否漏液
D.用图丁所示装置以NaOH 待测液滴定H2C2O4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知c(NH4Cl)<0.1molL﹣1时,溶液的pH>5.1,现用0.1molL﹣1盐酸滴定10mL 0.05molL﹣1氨水,用甲基橙作指示剂,达到终点时所用盐酸的量应是( )
A.10 mL
B.5 mL
C.大于5 mL
D.小于5 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com