
 ,故答案为:
,故答案为: ;
;| 9g |
| 12g/mol |


科目:高中化学 来源: 题型:
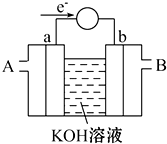
 如图是氢氧燃料电池构造示意图,电解质用的是30%的KOH溶液.关于该电池的说法不正确的是( )
如图是氢氧燃料电池构造示意图,电解质用的是30%的KOH溶液.关于该电池的说法不正确的是( )| A、a极是负极 |
| B、电子由b通过灯泡流向a |
| C、氢氧燃料电池是环保电池 |
| D、正极的电极反应是:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知2Cu(s)+
(1)已知2Cu(s)+| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
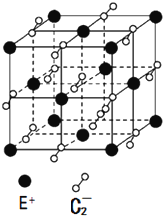 A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增.已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题.
A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增.已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯元素有三种同位素 |
| B、必存在质量数为36的同位素 |
| C、氯气分子的平均相对质量为72 |
| D、质量数最小的氯元素所占原子百分数为百分之75 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com