
【题目】在反应KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O中,被还原的氯原子和被氧化的氯原子的个数之比为
A.1:6 B.5:l C.1:5 D.6:1
科目:高中化学 来源: 题型:
【题目】下列溶液中氯离子的物质的量浓度与50 mL 1 mol·L-1AlCl3溶液中氯离子的物质的量浓度相等的是
A、150 mL 3 mol·L-1氯酸钠溶液 B、75 mL 3 mol·L-1氯化钙溶液
C、150 mL 3 mol·L-1氯化钾溶液 D、50 mL 3 mol·L-1氯化镁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. Fe2O3俗称磁性氧化铁,常用作红色油漆和涂料
B. 钠、钾合金(液态)可用于原子反应堆的导电材料
C. MgO、A12O3的熔点高,均可用作耐高温材料
D. C1O2具有还原性,可用于自来水的杀菌消毐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种由NaC1O2、NaC1O3和NaClO4组成的混合物,经测定氯元素的质量分数为35.5%,则此混合物中氧元素的质量分数为
A. 25.9% B. 23% C. 41.5% D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组欲采用如图所示的实验装置制备Cl2,同时进行与氯气有关的某些实验,按要求回答问题。
(1)A是浓盐酸,B是二氧化锰,将A滴入B中时发生反应的离子方程式为___________
(2)甲同学用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12 L,这是由于反应过程中盐酸浓度变小造成的。请列举导致盐酸浓度变小的原因:_____________________。
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则瓶①②中应盛放的试剂分别是①________________,②_______________(填试剂名称)。

(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224 mL(标准状况下)Cl2完全反应,则反应过程中转移电子的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) △H=a kJ mol-1 。
O2(g) △H=a kJ mol-1 。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
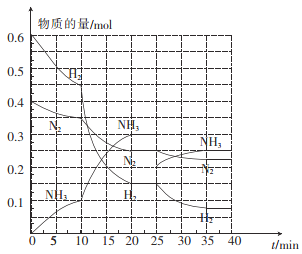
① 0~10 min内,以NH3表示的平均反应速率为_________。
② 在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 在反应进行至25 min时,曲线发生变化的原因是____________,达到第二次平衡时,新平衡的平衡常数K2______K1(填“>”“<”或“ = ”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com