
【题目】下列溶液中氯离子的物质的量浓度与50 mL 1 mol·L-1AlCl3溶液中氯离子的物质的量浓度相等的是
A、150 mL 3 mol·L-1氯酸钠溶液 B、75 mL 3 mol·L-1氯化钙溶液
C、150 mL 3 mol·L-1氯化钾溶液 D、50 mL 3 mol·L-1氯化镁溶液
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】将pH相同的三种酸性溶液露置于空气中一段时间后(不考虑水的挥发),溶液的pH随时间的变化情况如图所示。则a、b、c三种溶液可能分别为( )
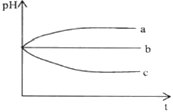
A.H2S溶液、稀H2SO4 溶液、H2SO3 溶液
B.氯水、稀HNO3 溶液、NH4Cl溶液
C.H2SO3 溶液、稀HCl溶液、氯水
D.H2S溶液、浓盐酸、H2SO3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证NaHCO3固体中是否含有Na2CO3 , 下列实验事实及判断中,正确的是( )
A.溶于水后加石灰水,看有无沉淀
B.加稀盐酸观察是否有气体产生
C.溶于水后加CaCl2溶液,看有无沉淀
D.在无色火焰上灼烧,观察火焰是否呈黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、l0lkPa下,煤炭、氢气、天然气和甲醇(CH3OH)四种燃料的热值(指一定条件下,单位质量的物质完全燃烧所放出的热量)依次是33kJ·g-1、143 kJ·g-1、56 kJ·g-1、23 kJ·g-1。则下列热化学方程式正确的是
A. C(s)+l/2O2(g)=CO(g) △H= -396kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l) △H= -286 kJ·mol-1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -896 kJ·mol-1
D. CH3OH(l)+O2(g)=CO2(g)+2H2O(l) △H= -736 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q、W、R、T是元素周期表短期中最常见的主族元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 其某一种同位素,被用作相对原子质量的标准 |
Y | 其最高价氧化物对应水化物能与其气态氢化物发生化合反应 |
P | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 存在质量数为25、中子数为13的核素 |
W | 位于周期表第13列 |
R | 与Z同族, 且最高价氧化物对应水化物的浓溶液常温下与W 单质会出现钝化现象 |
(1)W元素位于周期表第________周期______族;T离子的结构示意图为____________。
(2)将Q、Z、R的简单离子的半径从大到小排序___________(用离子符号表示);R、T两种元素的最高价氧化物对应水化物的酸(或碱)性由强到弱的顺序为__________(用化学式表示)。
(3) X、Y、Z三种元素的简单氢化物中,稳定性最强的化合物的电子式为_________,化合物P2R溶液在空气中长期放置,会和氧气反应生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为______________。
(4)根据下表中的信息,判断下列化合物固态时的晶体类型(填“离子晶体”……等)。
化合物 | x3Y4 | R2T2 |
主要物理性质 | 硬度可以和金刚石相媲美,熔点>3600℃ | 常温下是一种橙黄色液体,熔点为-76°C |
晶体类型 | ________ | _________ |
(5)Q的单质能与X、Z形成的某种化合物反应,写出其化学方程式:______________。
(6)X与Q形成的lmol化合物Q2X3与水反应,生成2molMg(OH)2和1mol某气态烃,该烃分子中碳氢质量比为9: 1,写出该气态烃的结构简式_______,并写出Q2X3与水反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)可逆反应:N2O4![]() 2NO2,在体积不变的密闭容器中反应,下列说法中可判断该反应达到平衡状态的是 (选填序号)
2NO2,在体积不变的密闭容器中反应,下列说法中可判断该反应达到平衡状态的是 (选填序号)
①单位时间内生成2nmolNO2的同时生成n mol N2O4
②单位时间内消耗n mol N2O4的同时生成2n mol NO2
③容器中的压强不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
(2)373k时把0.12 mol无色的N2O4气体通入体积500 ml的密闭容器中,发生反应:
N2O4![]() 2NO2,容器中立即出现红棕色。反应进行到2s时,测得生成NO2的物质的量为0.01 mol;反应进行到60 s时达到平衡,此时容器内N2O4与NO2的物质的量相等。请计算: (本小题要求写出解过程)
2NO2,容器中立即出现红棕色。反应进行到2s时,测得生成NO2的物质的量为0.01 mol;反应进行到60 s时达到平衡,此时容器内N2O4与NO2的物质的量相等。请计算: (本小题要求写出解过程)
①开始2 s内以N2O4表示的化学反应速率;
②达到平衡时体系的压强与开始时体系的压强之比;
③达到平衡时,体系中NO2的物质的量浓度;
④N2O4的平衡转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 汽油、柴油和植物油都是碳氢化合物,燃烧只生成CO2和H2O
B. 油脂氢化可用于制作人造黄油
C. 丙三醇常用于制作汽车防冻液
D. 蛋白质是仅由碳、氢、氧元素组成的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.6.02×1023个SO2分子的质量为64g
D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O中,被还原的氯原子和被氧化的氯原子的个数之比为
A.1:6 B.5:l C.1:5 D.6:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com