
【题目】某同学胃酸过多,他应该用下列哪种药品治疗 ( )
A. 阿司匹林 B. 青霉素 C. 麻黄素 D. 胃舒平
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q、W、R、T是元素周期表短期中最常见的主族元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 其某一种同位素,被用作相对原子质量的标准 |
Y | 其最高价氧化物对应水化物能与其气态氢化物发生化合反应 |
P | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 存在质量数为25、中子数为13的核素 |
W | 位于周期表第13列 |
R | 与Z同族, 且最高价氧化物对应水化物的浓溶液常温下与W 单质会出现钝化现象 |
(1)W元素位于周期表第________周期______族;T离子的结构示意图为____________。
(2)将Q、Z、R的简单离子的半径从大到小排序___________(用离子符号表示);R、T两种元素的最高价氧化物对应水化物的酸(或碱)性由强到弱的顺序为__________(用化学式表示)。
(3) X、Y、Z三种元素的简单氢化物中,稳定性最强的化合物的电子式为_________,化合物P2R溶液在空气中长期放置,会和氧气反应生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为______________。
(4)根据下表中的信息,判断下列化合物固态时的晶体类型(填“离子晶体”……等)。
化合物 | x3Y4 | R2T2 |
主要物理性质 | 硬度可以和金刚石相媲美,熔点>3600℃ | 常温下是一种橙黄色液体,熔点为-76°C |
晶体类型 | ________ | _________ |
(5)Q的单质能与X、Z形成的某种化合物反应,写出其化学方程式:______________。
(6)X与Q形成的lmol化合物Q2X3与水反应,生成2molMg(OH)2和1mol某气态烃,该烃分子中碳氢质量比为9: 1,写出该气态烃的结构简式_______,并写出Q2X3与水反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中所含的杂质(括号中是杂质),使用NaOH溶液不能除去的是
A. MgO固体(Al2O3) B. Na2CO3固体(NaHCO3)
C. FeCl2溶液(CuCl2) D. Fe2O3固体(SiO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
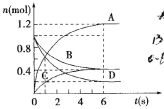
A.该反应的化学方程式为3B+4D=6A+2C
B.反应进行到6s时υ(B)=υ(C)
C.反应进行到6s时,用B表示的平均反应速率为0.05mol·L-1·s-1
D.反应进行到6s时,反应停止了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O中,被还原的氯原子和被氧化的氯原子的个数之比为
A.1:6 B.5:l C.1:5 D.6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A. 洗净的量筒和容量瓶不能放进烘箱中烘干
B. 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,再与标准比色卡对照
C. 实验时,先装好药品,再检查装置的气密性
D. 利用澄清石灰水吸收尾气中的Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)配制100 mL 0.10 mol·L-1NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→___ ___(冷却后)→洗涤(并将洗涤液移入容量瓶)→___ ___→___ ___→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量________g氢氧化钠固体所需仪器有:托盘天平(带砝码、镊子)、________、________。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用已配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是___________________________________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为_____________(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二锰(Mn2O3)在现代工业上位用广泛,在锂离子电池的制备中有重要的作用。 用软锰矿 (主要成分为MnO2)和硫锰矿(主要成分为MnS)制备高纯度Mn2O3的工艺流程如图所示。

(1) 反应①中会生成一种非金属单质,则该非金属单质是___________,该反应的还原剂是__________。(填化学式)
(2) 操作X为蒸发浓缩、_____________、过滤、洗涤烘干。在洗涤操作中,常用酒精洗涤MnSO4 H2O晶体,主要目的是______________。
(3) Mn2O3与MnO2类似,加热时也能与浓盐酸反应放出Cl2,该反应的离子方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com