
【题目】实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl质量分别是( )
A.950mL,111.2g B.500mL,117g C.1000mL,117g D.任意规格,111.2g
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示.下列说法不正确的是( )

A.图中五点Kw间的关系:B>C>A=D=E
B.若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则 溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A)
C.E 点对应的水溶液中,可能有NH 4+、Ba 2+、Cl-、I-大量同时存在
D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应: 2H++SO4 2-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制作印刷电路板。下列说法正确的是
A. 该反应为置换反应 B. 用KSCN溶液可检验废液中的Fe2+
C. 可用置换法回收废液中的铜 D. Fe3+能溶解Cu说明Cu比Fe金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某太阳能电池的工作原理如图所示。下列说法正确的是

A. 光照时,b极的电极反应式为VO2+-e-+H2O=VO2++2H+
B. 光照时,毎转移2mol电子,有2mol H+由a极区经质子交换膜向b极区迁移
C. 夜间,a极的电极反应式为V3++e-=V2+
D. 硅太阳能电池供电原理与该电池相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种主族元素分别位于三个不同的短周期,它们的原子序数依次增大,其中B、C、D位于同一周期,A与E位于同一主族,D的最外层电子数比B最外层电子数多2,C的最外层电子数是次外层的2.5倍.请回答下列问题:
(1)C、D氢化物中较稳定的是 ______ ;(填化学式)
(2)A、E可形成1:1型的化合物,两微粒间的化学键是 ______ ;写出C的气态氢化物的电子式 ______ ;
(3)写出D的一种同素异形体是 ______ .(写化学式)
(4)与B同族的单质在同周期元素中熔点最高、硬度最大,这种单质是 ______ ,熔点高、硬度大的原因是 _______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度下的2 L固定容积的密闭容器中,通入2 mol CO2和3 mol H2,发生的反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
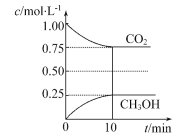
①能说明该反应已达平衡状态的是_____________(填编号)。
A.单位时间内每消耗1.2 mol H2,同时生成0.4 mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1∶1,且保持不变
②若要使K=1,则改变的条件可以是_____________(填选项)。
A增大压强 B减小压强 C升高温度 D降低温度 E加入催化剂
(2)有一种用CO2生产甲醇燃料的方法。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-bkJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH=-ckJ·mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为 。
(3)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)![]() 3C(g)+2D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
3C(g)+2D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
物质 | A | B | C | D |
起始投料/mol | 2 | 1 | 3 | 0 |
该反应的平衡常数表达式为K=__________。升高温度,平衡常数将__________(填“增大”“减小”或“不变”)。
p>(4)为研究不同条件对反应2NO(g)+Cl2(g)查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可用于制备净水剂明矾KAl(SO4)2·12H2O和补血剂FeSO4·7H2O。工艺流程如下(部分操作和产物略去):

(1)操作1的名称是___________。
(2)反应①②③④中是氧化还原反应的是_______(填写编号)。
(3)综合考虑,金属X最好选择的试剂是__,写出该反应离子方方程式_______。
(4)反应①的离子方程式是_________、__________。
(5)溶液D中含有的金属阳离子是_______,检验方法是________。
(6)用含铝元素27℅的上述矿石10吨,通过上述流程最多生产明矾____吨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com