
【题目】(1)在一定温度下的2 L固定容积的密闭容器中,通入2 mol CO2和3 mol H2,发生的反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
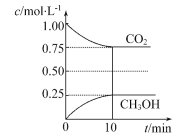
①能说明该反应已达平衡状态的是_____________(填编号)。
A.单位时间内每消耗1.2 mol H2,同时生成0.4 mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1∶1,且保持不变
②若要使K=1,则改变的条件可以是_____________(填选项)。
A增大压强 B减小压强 C升高温度 D降低温度 E加入催化剂
(2)有一种用CO2生产甲醇燃料的方法。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-bkJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH=-ckJ·mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为 。
(3)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)![]() 3C(g)+2D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
3C(g)+2D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
物质 | A | B | C | D |
起始投料/mol | 2 | 1 | 3 | 0 |
该反应的平衡常数表达式为K=__________。升高温度,平衡常数将__________(填“增大”“减小”或“不变”)。
p>(4)为研究不同条件对反应2NO(g)+Cl2(g)
【答案】
(1)①BC;②D;
(2)CH3OH(l)+3/2O2(g)=CO2(g)+3H2O(l)ΔH=-(3/2c-a-b)kJ·mol-1;
(3)K=c3(C)/〔c2(A)·c(B)〕;减小;(4)小于;
【解析】
试题分析:①未平衡时是个变量,现在不变说明已经达到平衡状态了。A.单位时间内每消耗1.2mol H2,向正方向,同时生成0.4mol H2O,也向正方向,不能反映正逆反应之间的关系,故A错误;B.未平衡CO2的体积分数是个变化的量,现在混合气体CO2的体积分数保持不变,说明已经平衡了,故B正确;C.未平衡时混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故C正确;D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的量不再随时间的变化而变化,故C错误;故选BC;
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始(mol/L) 1 1.5 0 0
变化(mol/L) 0.25 0.75 0.25 0.25
平衡(mol/L) 0.75 0.75 0.25 0.25
所以 K=![]() =0.20,而平衡常数是温度的函数,只有通过改变温度来改变平衡常数,正反应量放热反应,降低温度,K值变大,变化为1,故答案为:D;
=0.20,而平衡常数是温度的函数,只有通过改变温度来改变平衡常数,正反应量放热反应,降低温度,K值变大,变化为1,故答案为:D;
(2)①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
②CH3OH(g)=CH3OH(l) ΔH=-bkJ·mol-1;
③2H2(g)+O2(g)=2H2O(l) ΔH=-ckJ·mol-1;
根据盖斯定律,将![]() ×③-①-②得:CH3OH(l)+3/2O2(g)=CO2(g)+3H2O(l)
×③-①-②得:CH3OH(l)+3/2O2(g)=CO2(g)+3H2O(l)
ΔH=![]() △H3-△H1-△H2=-(
△H3-△H1-△H2=-(![]() c-a-b)kJ·mol-1,故答案为:
c-a-b)kJ·mol-1,故答案为:
CH3OH(l)+3/2O2(g)=CO2(g)+3H2O(l)ΔH=![]() △H3-△H1-△H2=-(
△H3-△H1-△H2=-(![]() c-a-b)kJ·mol-1;
c-a-b)kJ·mol-1;
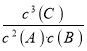 ;恒容压强与温度及其气体物质的量成正比,又由起始D的物质的量为0可知,反应2A(g)+B(g)
;恒容压强与温度及其气体物质的量成正比,又由起始D的物质的量为0可知,反应2A(g)+B(g) ![]() 3C(g)+2D(s),向正反应进行建立平衡,而气体物质的量不变,但压强增大,则说明该反应为放热反应,温度升高导致气体的压强增大。由①的分析得出该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,故答案为:
3C(g)+2D(s),向正反应进行建立平衡,而气体物质的量不变,但压强增大,则说明该反应为放热反应,温度升高导致气体的压强增大。由①的分析得出该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,故答案为: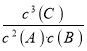 ;减小;
;减小;
(4)正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1;故答案为:小于。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
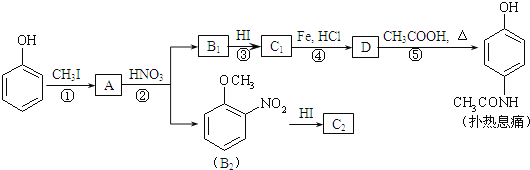
【题目】[化学—选修5:有机化学基础]对乙酰氨基酚,俗称扑热息痛(Paracetamol),具有很强的解热镇痛作用,工业上通过下列方法合成(图中B1和B2、C1和C2分别互为同分异构体,无机产物略去):
已知:![]() ,请按要求填空:
,请按要求填空:
(1)写出A分子中官能团名称:_________;C1的结构简式为:___________________。
(2)写出由D生成扑热息痛的化学方程式:_______________________。
(3)学出反应③和④的反应类型:③______________,④__________。
(4)工业上设计反应①、②、③,而不是只通过反应②得到C1、C2,其目的是:___________。
(5)扑热息痛有很多同分异构体,符合下列要求的同分异构体有5种:(1)是对位二取代苯;(II)苯环上两个取代基一个含氮不含碳、另一个含碳不含氮;(III)两个氧原子与同一原子相连。其中2种的结构简式是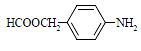 和
和![]() ,写出另3种同分异构体的结构简式____________、____________、____________。
,写出另3种同分异构体的结构简式____________、____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl质量分别是( )
A.950mL,111.2g B.500mL,117g C.1000mL,117g D.任意规格,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从原子序数11依次增加到17,下列所述递变关系中,错误的是( )
A.电子层数逐渐增多
B.原子半径逐渐减小
C.最高正化合价数值逐渐增大
D.从硅到氯,最低负化合价从﹣4到﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA
B. 标准状况下,4.48LCH3C1中所含原子数为NA
C. 1LpH=1的H2SO4溶液中含有的H+数为0.2NA
D. 常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《神农本草经》说:“水银……镕化(加热)还复为丹”。 《黄帝九鼎神丹经》中的“柔丹”“伏丹”都是在土釜中加热Hg制得的。 这里的“丹”是指
A. 合金 B. 氧化物 C. 氯化物 D. 硫化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mL B. 336mL C. 224mL D. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.04 g铜镁合金完全溶解于100 mL 14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体2240 mL(标准状况),向反应后的溶液中加入2.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2∶1
B.被还原的硝酸的物质的量是0.12 mol
C.得到5.08 g沉淀时,加入NaOH溶液的体积是700 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com