
【题目】1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mL B. 336mL C. 224mL D. 168mL
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制作印刷电路板。下列说法正确的是
A. 该反应为置换反应 B. 用KSCN溶液可检验废液中的Fe2+
C. 可用置换法回收废液中的铜 D. Fe3+能溶解Cu说明Cu比Fe金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度下的2 L固定容积的密闭容器中,通入2 mol CO2和3 mol H2,发生的反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
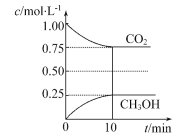
①能说明该反应已达平衡状态的是_____________(填编号)。
A.单位时间内每消耗1.2 mol H2,同时生成0.4 mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1∶1,且保持不变
②若要使K=1,则改变的条件可以是_____________(填选项)。
A增大压强 B减小压强 C升高温度 D降低温度 E加入催化剂
(2)有一种用CO2生产甲醇燃料的方法。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-bkJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH=-ckJ·mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为 。
(3)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)![]() 3C(g)+2D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
3C(g)+2D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
物质 | A | B | C | D |
起始投料/mol | 2 | 1 | 3 | 0 |
该反应的平衡常数表达式为K=__________。升高温度,平衡常数将__________(填“增大”“减小”或“不变”)。
p>(4)为研究不同条件对反应2NO(g)+Cl2(g)查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,22.4L CO2气体中
A. 含有1mol的O2分子 B. 碳元素的质量为6g
C. CO2分子数约为3.01×1023 D. CO2的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
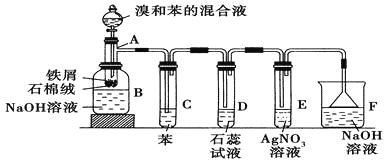
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):________________________。
(2)试管C中苯的作用是 。反应开始后,观察D和E两试管,看到的现象分别为 、 。
(3)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是 。
(4)在上述整套装置中具有防倒吸作用的仪器有 (填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项的括号内是除去杂质所用的试剂,错误的是( )
A. Cl2中混有HCl(饱和食盐水)
B. SiO2中混有CaCO3(盐酸)
C. CO2中混有SO2(饱和NaHCO3溶液)
D. FeSO4溶液中混有CuSO4(Zn粉)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可用于制备净水剂明矾KAl(SO4)2·12H2O和补血剂FeSO4·7H2O。工艺流程如下(部分操作和产物略去):

(1)操作1的名称是___________。
(2)反应①②③④中是氧化还原反应的是_______(填写编号)。
(3)综合考虑,金属X最好选择的试剂是__,写出该反应离子方方程式_______。
(4)反应①的离子方程式是_________、__________。
(5)溶液D中含有的金属阳离子是_______,检验方法是________。
(6)用含铝元素27℅的上述矿石10吨,通过上述流程最多生产明矾____吨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类或归类中正确的是( )
A. 化合物:HT、CaCl2、NaOH、盐酸
B. 纯净物:水玻璃、胆矾晶体、液氯、硫酸
C. 天然高分子化合物:淀粉、纤维素、蛋白质、聚氯乙烯
D. 同分异构体:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证SO2的性质,某同学利用输液管设计了如下微型实验:
回答下列问题:
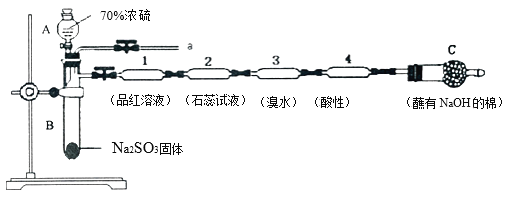
(1)仪器A的名称是__________。
(2)装置l中的现象是______;装置3中证明SO2具有______性。
(3)下列说法正确的是____________。
A.装置2中紫色石蕊试液变红的原因是SO2+H2O=H2SO3, H2SO3显酸性
B.实验结束后将输液管1加热溶液不变色
C.实验结束后,可由a导管向装置中加水,将气体赶出后再拆装置,防止残留的SO2有毒气体污染环境
D.在a导管处用向下排空气法收集SO2
(4)装置4中酸性高锰酸钾褪色,经测定反应后溶液中含有Mn2+和SO42—,请写出该反应的离子方程式__________。
(5)该学生还利用上图部分仪器组装成的装置(如图)证明S、C、Si非金属性强弱。可共选择的试剂有:硫酸、亚硫酸、硝酸、木炭、硅酸钠溶液。
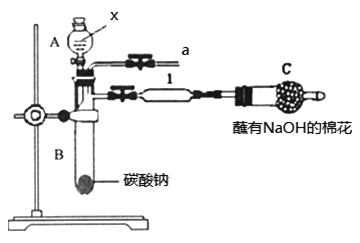
①装置A中试剂X是_______;装置1中反应的化学方程式是________。
②实验结论:因为酸性强弱是____>_____>_____(填化学式),故非金属性是S>C>Si。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com