
【题目】苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
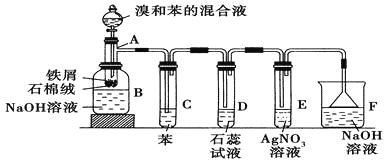
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):________________________。
(2)试管C中苯的作用是 。反应开始后,观察D和E两试管,看到的现象分别为 、 。
(3)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是 。
(4)在上述整套装置中具有防倒吸作用的仪器有 (填字母)。
【答案】(1)![]()
(2)吸收HBr气体中的Br2蒸气,D中石蕊试液变红,E中产生浅黄色沉淀
(3)NaOH溶液的底部有无色油珠产生(或分层,底部有无色油状液体)
(4)DEF(漏选得2分,错选不得分)
【解析】试题分析:(1)苯和液溴在Fe作催化剂时发生取代反应产生溴苯和HBr,反应的方程式为![]() ;
;
(2)由于溴单质溶液挥发产生溴蒸汽会干扰HBr的检验,所以在检验之前应该除去。试管C中苯的作用是:除去HBr气体中混有的溴蒸气;HBr的水溶液显酸性,氢溴酸有挥发性,挥发出的HBr遇空气形成氢溴酸的小液滴而产生白雾;HBr与AgNO3会发生沉淀反应而形成浅黄色沉淀。所以反应开始后,观察D和E两试管,看到的现象为:D试管中紫色石蕊试液慢慢变红,并在导管口有白雾产生,E试管中出现浅黄色沉淀。
(3)反应2~3 min后,由于产生的溴苯是液态物质,不容易溶于水,密度比水大,在B中的NaOH溶液里可观察到的现象是在溶液底部有无色油状液体;
(4)在上述整套装置中,具有防倒吸的仪器有D、E、F。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C,将两容器的温度恒定在770K,使反应3A(g)+B(g)![]() xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x=_________;若平衡时,甲、乙两容器中A的物质的量不相等,则x=_________。
(2)平衡时甲、乙两容器中A、B的物质的量之比是否相等____________(填“相等”或“不相等”),平衡时甲中A的体积分数为____________。
(3)若平衡时两容器中的压强不相等,则两容器中压强之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA
B. 标准状况下,4.48LCH3C1中所含原子数为NA
C. 1LpH=1的H2SO4溶液中含有的H+数为0.2NA
D. 常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:A、B、C三种气体都是大气的主要污染物,A是一种单质,其水溶液具有杀菌消毒作用,B是形成酸雨的主要污染物,C是硝酸工业和汽车尾气中的有害物质之一,能与水反应。请回答下列问题:
(1)A用于工业上制取漂白粉的化学方程式:________________.
(2)B在一定条件下与氧气反应的化学方程式:________________。
(3)A、B都能分别使品红溶液褪色,但两者水溶液混合后却不能使品红溶液褪色且溶液酸性增强:________________(用离子方程式表示),其中氧化剂和还原剂分别是________、________(填化学式),
(4)C与水反应的化学方程式:_________________。
II:汽车尾气(含CO、SO2和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排放管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体,并促进二氧化硫的转化.
(1)汽车尾气中导致酸雨形成的主要物质是_______________.
(2)写出在催化剂的作用下CO跟NO反应的化学方程式: ___________________.

(3)实验室一般用________(填化学式)溶液吸收除去尾气二氧化氮。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mL B. 336mL C. 224mL D. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺俗称“蛋白精”,工业上通过下列流程合成三聚氰胺。请回答下列问题:

(1)基态Ca原子的电子排布式:___________________;CaC2的电子式________________。
(2)尿素分子中所含除氢以外元素第一电离能由小到大的顺序为________________。
(3)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),由此可以推知CN22-的空间构型为________。
(4)三聚氰胺分子中碳原子的杂化方式为________,分子中处于同一平面的氮原子有_____个。
(5)动物摄入三聚氰胺和三聚氰酸 后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(6)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______________,已知CaO晶体的密度为ρ,用NA表示阿伏伽德罗常数,求晶胞中距离最近的两个钙离子之间的距离__________(用含ρ、NA代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质,可利用明矾石制备氢氧化铝。
(1)已知明矾石脱水后要硫化,化学方程式为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,该反应的氧化剂与还原剂的物质的量之比是___________;若生成1 mol Al2O3,则转移的电子数为________。
2Al2O3+9SO2,该反应的氧化剂与还原剂的物质的量之比是___________;若生成1 mol Al2O3,则转移的电子数为________。
(2)证明废渣中含有Fe2O3 的化学方法:_____________________。
II.镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为:Mg17Al12 + 17H2=17MgH2 + 12Al ,得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
(3)熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_____________________
(4)在6.0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2的物质的量为_______mol。(已知:MgH2 + 2HCl = MgCl2 + 2H2↑)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com