
【题目】电解质溶液电导率越大导电能力越强.常温下用0.100mol·L-1盐酸分别滴定10.00mL浓度均为0.100mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氮相似,常温Kb[(CH3)2NH]=1.6×10-4。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
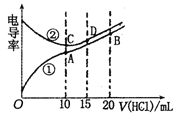
A. 曲线②代表滴定二甲胺溶液的曲线
B. A点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
C. D点溶液中:2c(Na+)=3c(Cl-)
D. 在相同温度下,A、B、C、D四点的溶液中,水的电离程度最大的是C点
【答案】B
【解析】A.等浓度的NaOH和二甲胺[(CH3)2NH]溶液,NaOH溶液的导电能力强,则曲线①为(CH3)2NHH2O的变化曲线,故A错误;B.A点溶液中,存在质子守恒,即:c(H+)=c(OH-)+c[(CH3)2NHH2O],故B正确;C.定量分析可知,D点溶液中,1.5c(Na+)=c(Cl-),即3c(Na+)=2c(Cl-),故C错误;D.酸或碱抑制水电离,含有弱离子的盐促进水电离,C点溶质为NaCl对水的电离无影响;A点溶质为(CH3)2NH2+·Cl-,促进水电离;B点为等物质的量浓度的(CH3)2NH2+·Cl-和HCl,HCl会抑制水的电离;D点为NaCl和HCl,HCl会抑制水的电离,所以在相同温度下,水的电离程度最大的点为A点,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】选用一种试剂就能把浓度均为lmol/L的CuCl2、Na2SO4、NaNO3、AlCl3溶液加以区别,这种试剂是
A. CaCl2 B. AgNO3 C. Ba(OH)2 D. H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环保部门每天通过新闻媒体向社会发布以污染物浓度为标准确定空气质量的信息。在下列各种物质中不属于空气质量指标的是( )
A. 二氧化碳 B. 氮氧化物
C. 二氧化硫 D. 悬浮颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用含有少量氯化钙的氯化钠固体,配制溶质的质量分数为a%的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:

(1)称量粗盐样品m g,在托盘天平左盘上放________,右盘上放________。
(2)过滤时,漏斗下端管口应________,漏斗里液面应____________。
(3)蒸发操作时应将液体放在________中加热,等加热至________时即停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,反应的化学方程式为_______________________。
(5)在滤液中加入盐酸的作用是__________________,反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四个图像的说法中,不正确的是

A. 若用甲表示某可逆反应的能量变化,说明催化剂能改变正、逆反应的活化能
B. 图乙表示在含Mg2+、Al3+、NH4+、Cl-的溶液中,加入一定浓度NaOH溶液时生成沉淀的图像,由图可得原溶液中,n(Mg2+):n(Al3+):n(NH4+)=10:2:3
C. 图丙表示MOH和ROH两种一元酸的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH
D. 图丁表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶液由a点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也。”天为上,所以中国古代通常称青金石为帝王石,明淸尤重。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)铝元素基态原子的外围电子轨道表示式为_____________,基态硅原子核外电子占有的原子轨道数为_____________个,氧、硫、氯的第一电离能由大到小顺序为________________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子空间构型为__________。
(3)第四周期中,与氯原子未成对电子数相同的金属元素有_______种。
(4)晶体硅的结构与金刚石非常相似。金刚石、晶体硅和金刚砂(碳化硅)的熔点由高到低的顺序为____________(填化学式)。
(5)下表是一组物质的沸点数据:
有机物 | 甲醇(CH3OH) | 丙烯(CH3CH=CH2) | 一氟甲烷(CH3F) |
相对分子质量 | 32 | 42 | 34 |
沸点/℃ | 64.7 | -47.7 | -78.2 |
若只考虑相对分子质量,甲醇沸点应低于-78.2℃,甲醇沸点高的原因是________。
丙烯中含有的α键与π键个数之比为______________。
(6)铝单质为面心立方晶体,其晶胞结构如图,晶胞参数qcm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,该晶体的空间利用率为_______________(只要求列算式,不必计算出数值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列有关化合物中存在的化学键种类的说法中正确的是
A. MgCl2中既存在离子键也存在共价键
B. CH3COOH中只有离子键
C. Na2O2中只存在离子键
D. NH4HSO4中既存在共价键也存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合F是一种重要的有机合成中间体,它的合成路线如下:
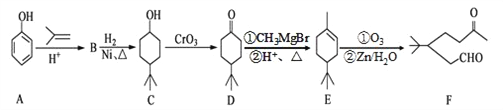
请认真分析和推理回答下列问题:
⑴化合物F中含氧官能团的名称是_______________;
⑵写出化合物C与乙酸反应生成酯的化学方程式:
____________________________________________________________________。
⑶写出化合物B的结构简式:_______________________________。
同时满足下列条件的B的同分异构体(不包括B)共有___________种:
①苯环上只有两个取代基 ②能与FeCl3溶液显紫色
⑷工业上以苯酚(![]() )和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线流程图如下:
)和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线流程图如下:
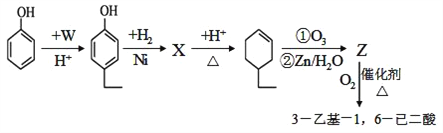
提示:3-乙基-1,6-已二酸的结构简如下图:
①写出X、Z的结构简式:
X:__________________________,Z:_________________________;
②写出苯酚与W反应的化学方程式:
_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com