
【题目】铜是生产和生活中用量较多的金属。
(1)下列有关铜元素的说法中,不正确的是__________(填字母)
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.铜与O2反应生成黑色的CuO
D.CuSO4·5H2O是一种混合物,加热后变为白色固体
(2)某化学小组为测定某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
①请写出方案Ⅰ中铜与稀硝酸反应的离子方程式:___________,该方案中稀硝酸表现出来的性质是___________(填字母)。
A.挥发性 B.酸性 C.氧化性 D.还原性
②方案Ⅱ比方案Ⅰ更易于实施,理由是________________。请写出方案Ⅱ中发生反应的化学方程式:____________,该反应产生气体在标准状况下的体积为________(铜铝混合物质量是m1g,反应后剩余固体的质量m2g,用含m1、m2的代数式表示)。
【答案】BD 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O BC 称量操作简单宜行 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ![]()
【解析】
(1)A.根据合金的定义判断;
B.铜生成碱式碳酸铜,较为疏松;
C.铜与O2反应生成氧化铜,为黑色固体;
D.CuSO45H2O为纯净物。
(2)①铜与稀硝酸反应生成硝酸铜,NO和水;依据硝酸在反应中氮元素化合价变化判断硝酸表现的性质;
②铝为活泼金属,可与强酸,也可与强碱反应生成氢气,根据反应前后质量差可计算出Al的质量,利用Al与NaOH溶液反应方程式中Al与H2的物质的量关系可计算出氢气在标准状况下的体积。
(1)A.青铜是铜锡合金、不锈钢是铁铬、镍合金、硬铝是铝硅、镁等形成的合金,A正确;
B.铜生成碱式碳酸铜,较为疏松,B错误;
C.铜与O2反应生成氧化铜,为黑色固体,C正确;
D.CuSO45H2O为纯净物,加热后变为白色的固体CuSO4,D错误;
故合理选项是BD;
(2)①铜与稀硝酸反应生成Cu(NO3)2,NO和H2O,反应的离子方程式:3Cu+8H++NO3-=3Cu2++2NO↑+4H2O;反应中NO3-中N元素部分化合价降低,表现氧化性,部分化合价不变表现酸性,故合理选项是BC;
②测量气体的体积不如测量固体的质量简单易操作,所以方案Ⅱ比方案Ⅰ更易于实施,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
铜铝混合物质量是m1,反应后未反应的Cu的质量为m2,则反应的Al的质量m(Al)=(m1-m2)g,Al的物质的量为n(Al)=![]() mol,根据方程式中Al与H2的物质的量关系可知n(H2)=
mol,根据方程式中Al与H2的物质的量关系可知n(H2)=![]() n(Al)=
n(Al)=![]() mol=
mol=![]() mol,则反应产生的氢气在标准状况下的体积V(H2)=n·Vm=
mol,则反应产生的氢气在标准状况下的体积V(H2)=n·Vm=![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L。
L。


科目:高中化学 来源: 题型:
【题目】(1)已知拆开1molH-H键、1molN≡N、1molN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则由N2和H2反应生成1molNH3需要放出___kJ的热量。
(2)把0.2molX气体和0.4molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=nZ(g)+6W(g);2min末生成0.3molW。若测知Z的浓度变化表示的反应速率为0.05mol/(Lmin)。计算:
①前2min内用Y的浓度变化表示的反应速率为___。
②化学方程式中n的值是___。
(3)某温度时在2L容器中A、B、C三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
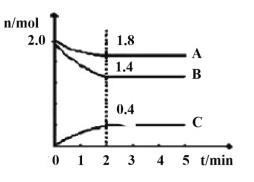
该反应的化学方程式为____。
下列叙述能说明上述反应达到平衡状态的是___。
A.混合气体的平均摩尔质量不随时间的变化而变化
B.相同时间内消耗2nmol的A的同时生成4nmol的C
C.混合气体的密度不随时间的变化而变化
D.容器内压强不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是( )
2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是( )
A.AlN中氮元素的化合价为+3
B.上述反应中,N2是还原剂,Al2O3是氧化剂
C.上述反应中,每生成1molAlN需转移6mol电子
D.AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在常温下均为非自发反应,在高温下仍为非自发反应的是
A. Ag2O(s)===2Ag(s)+![]() O2(g)
O2(g)
B. Fe2O3(s)+![]() C(s)===2Fe(s)+
C(s)===2Fe(s)+![]() CO2(g)
CO2(g)
C. N2O4(g)===2NO2(g)
D. 6C(s)+6H2O(l)===C6H12O6(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料.
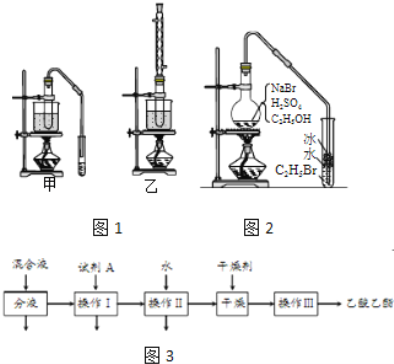
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______.
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是______(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______.(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置如图1都可以选用.关于这两套装置的说法正确的是______.(选填编号)
物质 | 沸点(℃) |
乙醇 | 78.5 |
乙酸 | 117.9 |
乙酸乙酯 | 77 |
a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3,以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物.
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇.
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色.与方案①相比较,方案②的明显缺点是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

己知:Zn及其化合物的性质与Al及其化合物的性质相似。下列相关说法错误的是( )
A. 用NaOH溶液处理废旧镀锌铁皮的作用是去除油污、溶解镀锌层
B. 调节溶液A的pH产生Zn(OH)2沉淀,经抽滤、洗涤、灼烧即可制得ZnO
C. 由溶液B制得Fe3O4胶体粒子的过程中,须持续通N2,其原因是防止Fe2+被氧化
D. Fe3O4胶体粒子能用减压过滤法实现固液分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断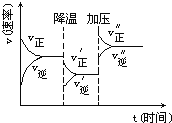
A. A、B、C、D均为气体
B. 若A、B是气体,则C、D是液体或固体
C. 温度越高,K越大
D. 在整个过程中,A的转化率一直增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com