
【题目】请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。

(1)A极发生的电极反应式是___________ ,B极发生的电极反应式是_____________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接_____、 ____接______;B接______、_____接______ 。
(3)在实验中,盛有KI淀粉溶液的容器中发生反应的离子方程式为_________________。
(4)已知饱和食盐水50mL(假设NaCl足量且忽略溶液体积变化),某时刻测得H2体积为16.8 mL(标准状况)。此时溶液OH- 浓度为___________。
(5)已知甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行上述饱和食盐水电解实验。若甲烷通入量为2.24L(标准状况),且反应完全,则理论上电解池产生的为Cl2 的物质的量为______
【答案】A极反应式2H++2e-= H2 B极反应式是 2Cl--2e-=Cl2 G F H D E C Cl2+2I-=2Cl-+I2 0.03mol·L-1 0.4mol
【解析】
根据电解池的工作原理及本质分析解答;根据物质的量计算分析解答。
(1)A极应作阴极,H+放电,电极反应式是2 H++2e-=H2↑,B极是阳极,Cl-放电,电极反应式是2 Cl--2e-= Cl2↑电解饱和食盐水的化学方程式是2NaCl+2H2O![]() 2NaOH+ H2↑+ Cl2↑;故答案为:A极反应式2H++2e-= H2 ,B极反应式是 2Cl--2e-=Cl2;
2NaOH+ H2↑+ Cl2↑;故答案为:A极反应式2H++2e-= H2 ,B极反应式是 2Cl--2e-=Cl2;
(2) 收集氢气用排水集气法,所以A→G→F→H,验证氯气的氧化性用淀粉碘化钾溶液,剩余氯气用氢氧化钠溶液吸收,所以B→D→E→C,整体连起来为H、F、G、A、B、D、E、C;故答案为: G, F , H ,D,E,C ;
(3) 在盛有KI淀粉溶液的容器中发生反应是氯气置换碘的反应,离子方程式为Cl2+2I-=2 Cl-+2I2,故答案为:Cl2+2I-=2Cl-+I2;
(4) 根据方程式是2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,可知2n(H2)=n(NaOH),其中n(H2)=0.00075mol,所以n(NaOH)=0.0015mol,c(NaOH)=0.03mol/L,故答案为:0.03mol.L-1
2NaOH+H2↑+Cl2↑,可知2n(H2)=n(NaOH),其中n(H2)=0.00075mol,所以n(NaOH)=0.0015mol,c(NaOH)=0.03mol/L,故答案为:0.03mol.L-1
(5) 甲烷共计是2.24L,物质的量是0.1mol,转移电子是0.8mol,所以根据电子的得失守恒可知,生成氯气是0.4mol,故答案为:0.4mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下
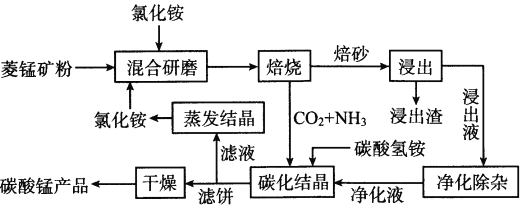
已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属离子[c0(Mn+)=0.1mol/L形成氢氧化物沉淀的pH范围如下:

③常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为__________________。
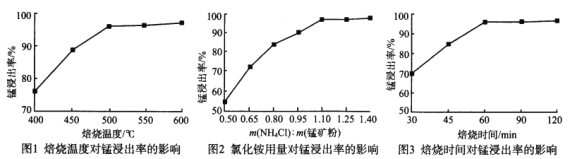
分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为_________、氯化铵与锰矿粉的质量之比为_________、焙烧时间为_________。
(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为_________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为_________;然后加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中c(Ca2+)/c(Mg2+)=_________。
(3)碳化结晶时,反应的离子方程式为__________________。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
①6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
②H2(g)+![]() O2(g)=H2O(g)△H2
O2(g)=H2O(g)△H2
③C(s)+O2(g)=CO2(g)△H3
④4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)△H4
下列说法不正确的是( )
A. △H4=12△H3+10△H2﹣2△H1
B. 若将①中 H2(g)改为 H2(l)则△H>△H1
C. C(金刚石,s)与 C(石墨,s)的燃烧热不同
D. △H2是 H2(g)的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g) ![]() cC(g)+dD(g),压缩容积到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),压缩容积到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A. A的转化率变大 B. 平衡向正反应方向移动
C. A的体积分数变大 D. a>c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某简单微粒核外有18个电子,下列关于该微粒的说法正确的是( )
A.该微粒一定具有氧化性B.该微粒一定具有还原性
C.该微粒一定既无氧化性又无还原性D.该微粒可能有氧化性,也可能有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
③H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
则下列说法正确的是
A. H2(g)的燃烧热为571.6 kJ·mol-1
B. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D. 2molH2(g)在足量氧气中完全燃烧生成气态水放出热量大于571.6kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A.b为电池的负极,甲醛被氧化
B.a极的电极反应为O2+4e-+4H+==2H2O
C.传感器工作过程中,电解质溶液中硫酸的浓度不变
D.当电路中转移1×10-4 mol电子时,传感器内参加反应的HCHO为0.75 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中键角由大到小排列的是
①BCl3 ②NH3 ③H2O ④PCl4+ ⑤BeCl2
A. ⑤④①②③ B. ④①②⑤③ C. ⑤①④②③ D. ③②④①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草衍义》中对精制砒霜过程有如下描述:“取砒之法,将生砒就置火上,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的混合物分离的操作方法是( )
A. 升华 B. 蒸发 C. 蒸馏 D. 萃取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com