
【题目】在密闭容器中发生下列反应aA(g) ![]() cC(g)+dD(g),压缩容积到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),压缩容积到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A. A的转化率变大 B. 平衡向正反应方向移动
C. A的体积分数变大 D. a>c+d
【答案】C
【解析】
假定平衡不移动,将气体体积压缩到原来的一半,D的浓度为原来的2倍,实际再次达到新平衡时,D的浓度为原来的1.8倍,说明增大压强,平衡向逆反应移动,即a<c+d,压强增大,速率加快,新平衡的正、逆速率都大于原平衡。A、平衡向逆反应移动,A的转化率降低,故A错误;B、气体体积压缩到原来的一半,D的浓度为原来的1.8倍,说明压强增大,平衡向逆反应移动,故B错误;C、气体体积压缩到原来的一半,C的浓度为原来的1.8倍,说明压强增大,平衡向逆反应移动,A的体积分数增大,故C正确;D、气体体积压缩到原来的一半,D的浓度为原来的1.8倍,说明压强增大,平衡向逆反应移动,反应物气体体积小于生成物,a<c+d,故D错误;故选C。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】A~F是几种烃分子的球棍模型(如下图),据此回答下列问题:
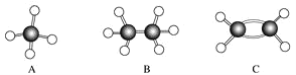
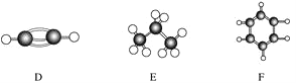
(1)属于同系物的是________;
(2)常温下含碳量最高的气态烃的分子式是____________________________________;
(3)能够发生加成反应的烃有(填数字)________种;
(4)写出C与溴的四氯化碳溶液反应的化学方程式________________;
(5)写出F与溴发生取代反应的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应aA+bB![]() cC中,5分钟时分别测得在不同温度下物质的含量A%和C%,绘制变化曲线如图所示,下列说法正确的是( )
cC中,5分钟时分别测得在不同温度下物质的含量A%和C%,绘制变化曲线如图所示,下列说法正确的是( )
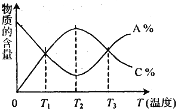
A. 该反应在T1、T3温度时达到过化学平衡
B. 该反应在T2温度时达到过化学平衡
C. 该反应的逆反应是放热反应
D. 升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关1~18号元素的原子核外电子排布规律的描述正确的是( )
A.最外层电子数为1的金属元素有3种
B.最外层电子数为2的元素一定是金属元素
C.K层与L层电子数之比为1:2的元素有2种
D.最外层电子数为8的元素一定是稀有气体元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g) ![]() CH3OH(g),现在实验室模拟该反应并进行分析。
CH3OH(g),现在实验室模拟该反应并进行分析。
(1)下图是该反应在不同温度下CO的转化率随时间变化的曲线。
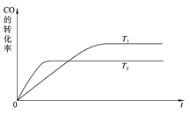
①该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
(2)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示
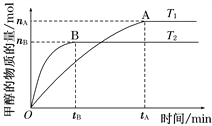
下列说法正确的是________(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=nA/tAmol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(3)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所得溶液的物质的量浓度一定为1.0mol/L 的是
A. 1.0克 NaCl固体溶于1L水中所得溶液
B. 1mol NaCl固体溶于1L水中所得溶液
C. 22.4L HCl气体溶于水配成1L溶液
D. 4.0克NaOH固体溶于水配成100mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。

(1)A极发生的电极反应式是___________ ,B极发生的电极反应式是_____________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接_____、 ____接______;B接______、_____接______ 。
(3)在实验中,盛有KI淀粉溶液的容器中发生反应的离子方程式为_________________。
(4)已知饱和食盐水50mL(假设NaCl足量且忽略溶液体积变化),某时刻测得H2体积为16.8 mL(标准状况)。此时溶液OH- 浓度为___________。
(5)已知甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行上述饱和食盐水电解实验。若甲烷通入量为2.24L(标准状况),且反应完全,则理论上电解池产生的为Cl2 的物质的量为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)![]() qZ(g)的△H < 0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的△H < 0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A. 通入稀有气体使压强增大,平衡将正向移动
B. X的正反应速率是Y的逆反应速率的n/m倍
C. 增加X的物质的量,Y的转化率降低
D. 降低温度,混合气体的平均相对分子质量变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸溶液中c(H+)=0.1 mol·L-1,则该溶液的物质的量浓度( )
A.一定等于0.1 mol·L-1B.一定大于0.1 mol·L-1
C.一定小于0.1 mol·L-1D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com