
下列反应现象中,叙述正确的是( )
A.灼热的铁丝在氯气中燃烧,集气瓶内产生棕黄色烟雾
B.氢气在氯气中燃烧,集气瓶口有白雾
C.钠在氯气中燃烧,集气瓶内产生大量的白色烟雾
D.灼热的铜丝在氯气中燃烧,集气瓶内产生棕红色烟
科目:高中化学 来源: 题型:
下列有关溶液的说法中,正确的是
A.含H+的溶液显酸性,含OH—的溶液显碱性
B.用丁达尔现象实验可区分葡萄糖溶液和氢氧化铁胶体
C.某饱和溶液变成不饱和溶液,溶质的质量分数一定减小
D.标准状况2.24 L NH3溶于水制得1L氨水,则c(NH3·H2O)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组溶液:①汽油和氯化钠溶液 ②碘的CCl4溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.萃取、蒸发、分液 B.分液、蒸馏、萃取
C.分液、萃取、蒸馏 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
现有25 mL 2 mol·L-1 Na2CO3溶液和75 mL 1 mol·L-1的稀盐酸。①将Na2CO3溶液缓慢滴到稀盐酸中;②将稀盐酸缓慢滴到Na2CO3溶液中,两操作的现象及结果(标准状况下)是( )
A.现象相同,所得气体的体积相等 B.现象相同,所得气体的体积不等
C.现象不同,所得气体的体积相等 D.现象不同,所得气体的体积不等
查看答案和解析>>
科目:高中化学 来源: 题型:
①1molH2O约含 个H2O;
②1molO约含 个e-;
③3× 6.02×1023个电子的物质的量是 mol e-;
④ 1.204×1024个水分子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
①可以燃烧; ②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应; ⑥能发生水解反应
A.①④ B.只有⑥ C.只有⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)中和热的测定是高中化学的定量实验之一.50 mL0.50 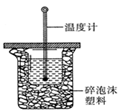 mol/L 盐酸与50 mL
mol/L 盐酸与50 mL
0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。从实验
装置上看,图中尚缺少的一种仪器是 。大烧杯上如不
盖硬纸板,求得的中和热数值将会
(填“偏大”、“偏小”或“无影响”)。
(2)氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的
影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条
件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法
 是 ________(填一种即可)。
是 ________(填一种即可)。
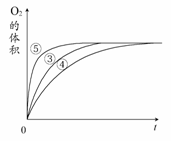
实验③④⑤中,测得生成氧气的体积随时间变化
的关系右图所示。
分析该图能够得出的实验结论是________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2
分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。
某同学通过测定O2的体积比较H2O2的分解速率快慢,实验时可以通过测量
________ 或 ________比较;
(2)0.1g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时
间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物
质的量浓度为________。(保留两位有效数字,在标准状况下测定)
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液
漏斗加入40 mL 2.5 mol/L的硫酸,10s时收集产生的H2体积为50 mL
(若折合成标准状况下的H2体积为44.8mL),用锌粒表示10s内该反应的速
率为______g/s;
根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法
不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高原料转化率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是
A.铜锌合金制成的假金元宝欺骗行人的事件屡有发生,可以把它放入硝酸中进行鉴别
B.装饰材料中的甲醛、芳香烃及氡等会造成居室污染
C.绿色食品是不含任何化学物质的食品
D.塑料的主要成分是合成树脂,有的塑料可以能导电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com