
(1)中和热的测定是高中化学的定量实验之一.50 mL0.50 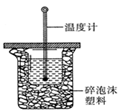 mol/L 盐酸与50 mL
mol/L 盐酸与50 mL
0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。从实验
装置上看,图中尚缺少的一种仪器是 。大烧杯上如不
盖硬纸板,求得的中和热数值将会
(填“偏大”、“偏小”或“无影响”)。
(2)氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的
影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条
件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法
 是 ________(填一种即可)。
是 ________(填一种即可)。
实验③④⑤中,测得生成氧气的体积随时间变化
的关系右图所示。
分析该图能够得出的实验结论是________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2
分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。
某同学通过测定O2的体积比较H2O2的分解速率快慢,实验时可以通过测量
________ 或 ________比较;
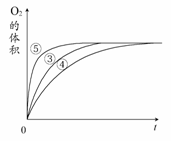
(2)0.1g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时
间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物
质的量浓度为________。(保留两位有效数字,在标准状况下测定)
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液
漏斗加入40 mL 2.5 mol/L的硫酸,10s时收集产生的H2体积为50 mL
(若折合成标准状况下的H2体积为44.8mL),用锌粒表示10s内该反应的速
率为______g/s;
根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法
不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高原料转化率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
一定质量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6 g,若其中水的质量为10.8 g,则CO的质量是
A. 4.4 g B. 1.4 g C. 2.2 g D. 在2.2 g和4.4 g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应现象中,叙述正确的是( )
A.灼热的铁丝在氯气中燃烧,集气瓶内产生棕黄色烟雾
B.氢气在氯气中燃烧,集气瓶口有白雾
C.钠在氯气中燃烧,集气瓶内产生大量的白色烟雾
D.灼热的铜丝在氯气中燃烧,集气瓶内产生棕红色烟
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石)ΔH = +1.9kJ/mol”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH = - 57.3kJ/mol,若将含
1molCH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧
的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)ΔH = —285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
反应N2O4(g) 2NO2(g)ΔH =+57 kJ·mol-1,在温度为T1、T2时,
2NO2(g)ΔH =+57 kJ·mol-1,在温度为T1、T2时,
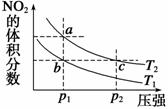 平衡体系中NO2的体积分数随压强(缩小体积)的
平衡体系中NO2的体积分数随压强(缩小体积)的
变化曲线如图所示。下列说法正确的是 ( )
A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深,c浅
C.由状态b到状态a,可以用加热的方法
D.a、c两点气体的平均相对分子质量:a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个
“封管实验”(夹持装置未画出),判断下列说法正确的是( )
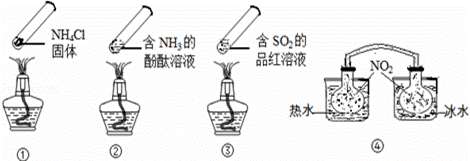
A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,②、③溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内
气体颜色变浅
D.四个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对实验现象的描述中错误的是
A.向FeCl3和KSCN混合溶液中加入少量KCl固体,溶液血红色变浅
B.向5mL0.1mol/LK2Cr2O7溶液中加入少量NaOH固体,溶液由橙色变为黄色
C.等体积等浓度Na2S2O3和H2SO4混合,温度升高出现浑浊和生成气体速度加快
D.酸性KMnO4溶液中滴加H2C2O4,H2C2O4浓度越大褪色和生成气体速度越快
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组名词或现象中,三者间没有逐级因果关系的是
A.汽车尾气--------光化学污染-------咳嗽和气喘者增多
B.含磷洗衣粉--------水体富营养化--------水栖生物大量死亡
C.人口增多--------空气中CO2浓度增大--------温室效应
D.氟氯烃-------- 臭氧空洞--------皮肤癌患者增多
查看答案和解析>>
科目:高中化学 来源: 题型:
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:
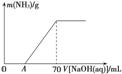
(1)A点前样品与NaOH反应的离子方程式为__________________________________
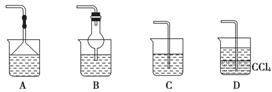
(2)为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的________。
(3)样品中(NH4)2CO3的质量分数是________%(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com