
����˵�����ʾ������ȷ����
A�������������������������ֱ���ȫȼ�գ����߷ų�������
B���ɡ�C(ʯī)��C(���ʯ)��H = +1.9kJ/mol����֪�����ʯ��ʯī�ȶ�
C����ϡ��Һ�У���+(aq)+OH-(aq)��H2O(l)����H = - 57.3kJ/mol��������
1molCH3COOH�뺬1mol NaOH����Һ��ϣ��ų�������С��57.3kJ
D����101kPaʱ,2gH2��ȫȼ������Һ̬ˮ,�ų�285.8kJ����������ȼ��
���Ȼ�ѧ����ʽ��ʾΪ2H2(g)+O2(g)��2H2O(l)��H = ��285.8kJ/mol

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ�����ӵ�������ֵ������˵����ȷ����
A��1mol C��4���еĵ�����ΪNA
B����״���£�2. 24L��CCl4�к��е���ԭ����Ϊ0.4NA
C�����³�ѹ�£�3.0g�����Ǻͱ�����Ļ�����к��е�ԭ������Ϊ0.4NA
D����״���£�2. 24L����Ȳ��̼ԭ����Ϊ0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����25 mL 2 mol��L��1 Na2CO3��Һ��75 mL 1 mol��L��1��ϡ���ᡣ�ٽ�Na2CO3��Һ�����ε�ϡ�����У��ڽ�ϡ���Ỻ���ε�Na2CO3��Һ�У��������������(��״����)��(����)
A��������ͬ����������������� B��������ͬ������������������
C������ͬ����������������� D������ͬ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1molH2OԼ�� ��H2O��
��1molOԼ�� ��e-��
��3�� 6.02��1023�����ӵ����ʵ����� mol e-��
�� 1.204��1024��ˮ���ӵ����ʵ���Ϊ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�л���ĽṹΪ��ͼ��ʾ�������л��ﲻ���ܾ��е������ǣ� ��
�ٿ���ȼ�գ� ����ʹ����KMnO4��Һ��ɫ��
���ܸ�NaOH��Һ��Ӧ�� ���ܷ���������Ӧ��
���ܷ����Ӿ۷�Ӧ�� ���ܷ���ˮ�ⷴӦ
A���٢� B��ֻ�Т� C��ֻ�Т� D���ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�������£����淴ӦX(g) + 3Y(g) 2Z(g)�ﵽƽ��ʱ��
2Z(g)�ﵽƽ��ʱ��
���Y��ת����Ϊ37.5%��X��ת����Ϊ25%����Ӧ��ʼʱ��
���������е�X��Y�����ʵ���֮���ǣ�
A.13 B.31 C.32 D.12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)�к��ȵIJⶨ�Ǹ��л�ѧ�Ķ���ʵ��֮һ.50 mL0.50 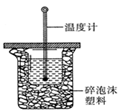 mol/L ������50 mL
mol/L ������50 mL
0.55 mol/L NaOH ��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��
ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ���ʵ��
װ���Ͽ���ͼ����ȱ�ٵ�һ�������� �����ձ����粻
��Ӳֽ�壬��õ��к�����ֵ����
���ƫ����ƫС������Ӱ�족����
��2��������H2O2�ڷ�Ӧʱ��������Ⱦ�����Ϊ��ɫ������������ܵ�����ԽԽ��Ĺ�ע��
��.ijʵ��С����H2O2�ֽ�Ϊ����̽��Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�
Ӱ�졣�ڳ����°����±���ʾ�ķ������ʵ�顣
| ʵ���� | ��Ӧ�� | ���� |
| �� | 10 mL 2% H2O2��Һ | �� |
| �� | 10 mL 5% H2O2��Һ | �� |
| �� | 10 mL 5% H2O2��Һ | 1 mL 0.1 mol��L��1FeCl3��Һ |
| �� | 10 mL 5% H2O2��Һ������HCl��Һ | 1 mL 0.1 mol��L��1FeCl3��Һ |
| �� | 10 mL 5% H2O2��Һ������NaOH��Һ | 1 mL 0.1 mol��L��1FeCl3��Һ |
(1)ʵ��ٺ͢ڵ�Ŀ����________��
ͬѧ�ǽ���ʵ��ʱû�й۲쵽������������ó����ۡ�������ʾ��ͨ����
����H2O2�ȶ������ֽ⡣Ϊ�˴ﵽʵ��Ŀ�ģ����ԭʵ�鷽���ĸĽ�����
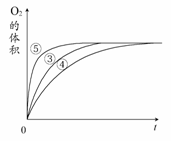 �� ________(��һ�ּ���)��
�� ________(��һ�ּ���)��
ʵ��ۢܢ��У�������������������ʱ��仯
�Ĺ�ϵ��ͼ��ʾ��
������ͼ�ܹ��ó���ʵ�������________��
��.������ʾ��ijЩ�������Ӷ�H2O2�ķֽ�������á�Ϊ�Ƚ�Fe3����Cu2����H2O2
�ֽ�Ĵ�Ч������ʵ��С���ͬѧ�������ͼ��ʾ��ʵ��װ�ý���ʵ�顣
ijͬѧͨ���ⶨO2������Ƚ�H2O2�ķֽ����ʿ�����ʵ��ʱ����ͨ������
________ �� ________�Ƚϣ�
(2)0.1g MnO2��ĩ����50 mL H2O2��Һ�У��ڱ�״���·ų�����������ʱ
��Ĺ�ϵ��ͼ��ʾ�����ͷ�Ӧ���ʱ仯��ԭ��________������H2O2�ij�ʼ��
�ʵ���Ũ��Ϊ________��(������λ��Ч���֣��ڱ�״���²ⶨ)
��.(1)Ϊ�˼����Ӱ�췴Ӧ�������ص���ʶ����ʦ�ü�ͬѧ�������ʵ�飺
�ڢ��е�ʵ��װ�õ���ƿ��ʢ6.5gп��(������С������ͬ)��ͨ����Һ
©������40 mL 2.5 mol/L�����ᣬ10sʱ�ռ�������H2���Ϊ50 mL
(���ۺϳɱ�״���µ�H2���Ϊ44.8mL)����п����ʾ10s�ڸ÷�Ӧ����
��Ϊ______g/s��
���ݻ�ѧ��Ӧ�����뻯ѧƽ�����ۣ���ϵ��������ʵ�ʣ�����Ϊ����˵��
����ȷ����________(�����)��
A����ѧ��Ӧ�������ۿ���ָ��������һ��ʱ���ڿ����Ʒ
B����������ԭ������ָ������ʹ����ԭ�϶����Ʒ
C��������ʹ�������ԭ��ת���ʵ���Ч�취
D����ȷ���û�ѧ��Ӧ���ʺͻ�ѧ��Ӧ�ȶ�����������������ۺϾ���Ч��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ���Ʊ�H2��һ����Ҫ�����ǣ�
CO(g) + H2O(g)  CO2 (g) + H2(g) ��H��Q kJ/mol
CO2 (g) + H2(g) ��H��Q kJ/mol
��֪
�÷�Ӧ��ƽ�ⳣ��K���¶�T�Ĺ�ϵ����ͼ��ʾ������һ�̶����ܱ������У�
850�� ʱ����������Ӧ����������ڸ����ʵ�Ũ�� (mol/L)��ʱ��ı仯
��ϵ���±���
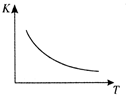
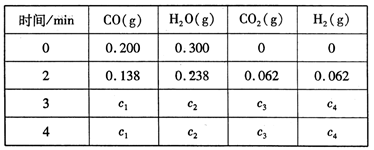
��֪��850�� ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��K = 1.0 ����ش��������⣺
(1) Q 0��� �� ������ �� ������ ����
����850��ʱ��Ӧ�����г���H2O(g),K ֵ (������С�����䣩
(3)�ϱ��� c2Ϊ mol/L , CO(g)��ת����Ϊ (������λ��Ч����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���бȽϲ���ȷ����
A����Ũ�ȵ�NH4HSO4�� NH3��H2O�� (NH4)2SO4��(NH4)2CO3��(NH4)2Fe(SO4)2��������Һ������(NH4)2Fe(SO4)2��Һ��c(NH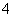 )���
)���
B. NaClO��BaCl2�����Һ�� c(Na��)��2c(Ba2��)��c(ClO��)��c(HClO)��c(Cl��)
C. 25 ���£�0.2 mol��L��1 HCl��Һ��0.2 mol��L��1 YOH(һԪ����)��Һ��������(���Ի�Ϻ���Һ����ı仯)����c(Cl-)��c(Y+)��c(YOH)��0.2 mol��L��1
D. �����£���0.2 mol��L��1ijһԪ��ROH��Һ��0.1 mol��L��1HCl��Һ������� �ϣ���Ϻ���ҺpH<7����c(ROH)>c(R��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com