
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个
“封管实验”(夹持装置未画出),判断下列说法正确的是( )
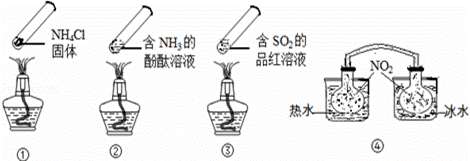
A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,②、③溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内
气体颜色变浅
D.四个“封管实验”中所发生的化学反应都是可逆反应
科目:高中化学 来源: 题型:
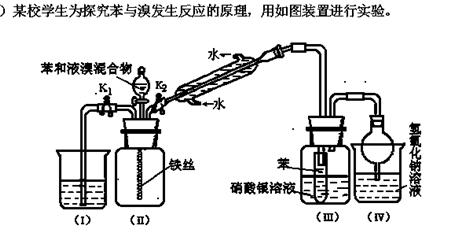
根据相关知识回答下列问题:
(1)实验开始时,关闭K1,开启K2和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。过一会儿,在(III)中可能观察到的现象是 ▲ 。
(2)整套实验装置中能防止倒吸的装置有 ▲ (填装置序号)。
(3)反应结束后要使装置(I)中的水倒吸入装置(II)中。这样操作的目的是 ▲ 。简述这一操作方法 ▲ 。
(4)你认为通过该实验后,有关苯跟溴反应的原理方面能得出的结论是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
①1molH2O约含 个H2O;
②1molO约含 个e-;
③3× 6.02×1023个电子的物质的量是 mol e-;
④ 1.204×1024个水分子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,可逆反应X(g) + 3Y(g) 2Z(g)达到平衡时,
2Z(g)达到平衡时,
测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,
充入容器中的X、Y的物质的量之比是:
A.13 B.31 C.32 D.12
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)中和热的测定是高中化学的定量实验之一.50 mL0.50 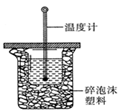 mol/L 盐酸与50 mL
mol/L 盐酸与50 mL
0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。从实验
装置上看,图中尚缺少的一种仪器是 。大烧杯上如不
盖硬纸板,求得的中和热数值将会
(填“偏大”、“偏小”或“无影响”)。
(2)氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的
影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条
件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法
 是 ________(填一种即可)。
是 ________(填一种即可)。
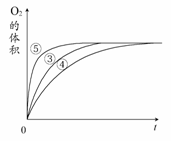
实验③④⑤中,测得生成氧气的体积随时间变化
的关系右图所示。
分析该图能够得出的实验结论是________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2
分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。
某同学通过测定O2的体积比较H2O2的分解速率快慢,实验时可以通过测量
________ 或 ________比较;
(2)0.1g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时
间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物
质的量浓度为________。(保留两位有效数字,在标准状况下测定)
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液
漏斗加入40 mL 2.5 mol/L的硫酸,10s时收集产生的H2体积为50 mL
(若折合成标准状况下的H2体积为44.8mL),用锌粒表示10s内该反应的速
率为______g/s;
根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法
不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高原料转化率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
科目:高中化学 来源: 题型:
用3g铁粉与30ml,3mol/L的盐酸反应制取氢气,若要加快产生氢气的速率
可采取措施是( )
A.改用浓H2SO4 B.改用6mol/L的盐酸
C.改用6mol/L的HNO3 D.改用6g的铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备H2的一种重要方法是:
CO(g) + H2O(g)  CO2 (g) + H2(g) △H=Q kJ/mol
CO2 (g) + H2(g) △H=Q kJ/mol
已知
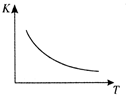
该反应的平衡常数K与温度T的关系右上图所示。若在一固定的密闭容器中,
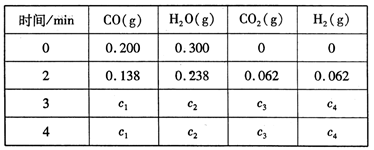
850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化
关系如下表:
已知:850℃ 时该反应的化学平衡常数K = 1.0 ,请回答下列问题:
(1) Q 0(填“ > ”、“ = ”或“<” )。
若在850℃时向反应容器中充人H2O(g),K 值 (填增大、减小、不变)
(3)上表中 c2为 mol/L , CO(g)的转化率为 (保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是小明同学血常规检查报告单中的部分内容,小明同学应注意补充的微量元素是
| 编号 | 项目 | 结果 | 正常范围参考值 | 单位 |
| 1 | 血红细胞计数 | 2.3[] | 3.5 ~ 5 | ×1012L-1 |
| 2 | 血红蛋白 | 75 | 110 ~ 150 | g·L-1 |
A.硒 B.锌 C. 碘 D. 铁
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与胶体性质无关的是
A.在豆浆里加入盐卤做豆腐
B.河流入海处易形成沙洲
C.一束平行光线照射蛋白质溶液时,从侧面可以看到光亮的通路
D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com