
【题目】在核电荷数为26的元素Fe的原子核外3d、4s 轨道内,下列电子排布图正确的是()
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.天然油脂都是混合物,没有恒定的熔点和沸点
B.用饱和Na2CO3溶液可以除去乙酸乙酯中的乙酸
C.![]() 的名称为2-乙基丙烷
的名称为2-乙基丙烷
D.有机物![]() 分子中所有碳原子不可能在同一个平面上
分子中所有碳原子不可能在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的基态原子的核外电子有3种能量状态、5种空间状态,X是其中第一电离能最小的元素;元素Y的M层电子运动状态与X的价电子运动状态相同;元素Z位于第四周期,其基态原子的2价阳离子M层轨道全部排满电子。
(1)X基态原子的电子排布式为___________。
(2)X的氢化物(H2X)在乙醇中的溶解度大于H2Y,其原因是___________。
(3)在Y的氢化物(H2Y分子中,Y原子轨道的杂化类型是___________。
(4)Y与X可形成YX32-。
①YX32-的立体构型为___________(用文字描述)。
②写出一种与YX32-互为等电子体的分子的化学式___________。
(5)Z的氯化物与氨水反应可形成配合物[Z(NH3)4(H2O)2]Cl2,该配合物加热时,首先失去配离子中的配体是___________(写化学式)。

(6)Y与Z所形成化合物晶体的晶胞如图所示,该化合物的化学式为___________。其晶胞边长为540.0pm,密度为___________g·cm-3(列式并计算),a位置Y与b位置Z之间的距离为___________pm(列式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C6H6O)是一种重要的化工原料,广泛用于制造树脂、医药等。
Ⅰ.以A、B为原料合成扁桃酸衍生F的路线如下。
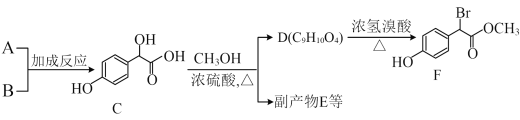
(1)A的名称是____;B的结构简式是____。
(2)C(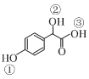 )中①~③羟基氢原子的活性由强到弱的顺序是____。
)中①~③羟基氢原子的活性由强到弱的顺序是____。
(3)D的结构简式是____。
(4)写出F与过量NaOH溶液反应的化学方程式:___________。
(5)若E分子中含有3个六元环,则E的结构简式是________。
Ⅱ.以A为原料合成重要的医药中间体K的路线如下。
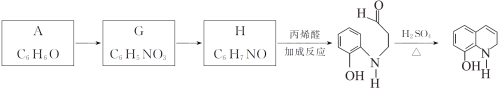
(6)G→H的反应类型是__________。
(7)一定条件下,K与G反应生成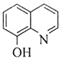 、H和水,化学方程式是__________。
、H和水,化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写化学方程式或离子方程式
①实验室制NH3的化学方程式:_______________________________
②MnO2与浓盐酸加热的离子方程式:____________________________
③Fe与高温H2O(g)的化学方程式:____________________________
④Cu与稀HNO3的离子方程式:_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨是富氢物质,是氢能的理想载体。下列说法不正确的是( )
A. NH3分子中氮原子的杂化方式为sp3杂化
B. [Cu(NH3)4]2+中,NH3分子是配体
C. 相同压强下,NH3的沸点比PH3的沸点低
D. NH4+与PH4+、CH4、BH4-互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用C、H、O、N、S五种元素回答下列问题
(1)除H外,其它四种元素中,第一电离能最大的元素基态原子电子排布图为______________,电负性最大的元素基态原子核外电子运动状态共有_________种。
(2)五种元素中,由其中两种元素构成甲、乙、丙、丁四种分子,所含原子的数目依次为3、4、6、8,都含有18个电子。甲和乙的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
甲 | 187 | 202 | 2.6 |
乙 | 272 | 423 | 以任意比互溶 |
①1mol乙分子含有_________个σ键;
②丁分子的中心原子采取_________杂化方式;甲分子的VSEPR模型为_________,丙分子为_________(“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下8种化合物中,不能通过化合反应直接生成的有
①Fe3O4 ②Fe(OH)3 ③FeCl2 ④Cu2(OH)2CO3 ⑤Al(OH)3 ⑥Na2CO3 ⑦NaHCO3 ⑧Na2O2
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。如果采用NaClO、Ca(ClO)2作吸收剂,能得到较好的烟气脱硫效果。已知下列反应:
SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq)=SO42-(aq)+Cl-(aq) ΔH2
CaSO4(s)=Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=_____。
(2)将0.1 mol MnO2粉末加入到50 mL过氧化氢溶液(H2O2,ρ=1.1 g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示。
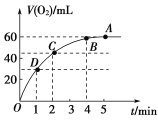
①实验时放出气体的总体积是________。
②放出一半气体所需的时间为______。
③反应放出![]() 体积气体所需的时间约为_______。
体积气体所需的时间约为_______。
④A,B,C,D各点反应速率的快慢顺序为______。
⑤解释反应速率变化的原因:_______。
⑥H2O2初始状态的浓度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com