
【题目】液氨是富氢物质,是氢能的理想载体。下列说法不正确的是( )
A. NH3分子中氮原子的杂化方式为sp3杂化
B. [Cu(NH3)4]2+中,NH3分子是配体
C. 相同压强下,NH3的沸点比PH3的沸点低
D. NH4+与PH4+、CH4、BH4-互为等电子体
科目:高中化学 来源: 题型:
【题目】工业上生产MnO2和Zn的主要反应有:
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4
下列说法不正确的是 ( )
A. ①中MnO2和H2SO4都是氧化剂 B. ①中析出16gS时转移1 mol电子
C. ②中MnSO4发生氧化反应 D. 硫酸在该生产中可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与材料、信息一起被称为现代社会发展的三大支柱。面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的两个主要方向。
(1)化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一。某同学为了探究锌与盐酸反应过程中的速率变化,在 400mL 稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:____min(填“0~1”或“1~2”或“2~3”或“3~4” 或“4~5”)。
②另一学生为控制反应速率防止反应过快难以测量氢气体积。他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量。你认为可行的是____(填字母序号)。
A.KCl 溶液 B.浓盐酸 C.蒸馏水 D.CuSO4 溶液
(2)如图为原电池装置示意图:
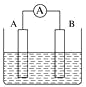
①若 A 为铝,B 为镁,电解质为稀硫酸溶液,则负极材料是_______(填“铝片”或“镁片”)。
②若A为Cu,B 为石墨,电解质为 FeCl3 溶液,工作时的总反应为 2FeCl3+Cu=2FeCl2+CuCl2。写出铜电极的电极反应式:____;若该电池反应消耗了 0.1mol FeCl3, 则转移电子的数目为 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是

A.甲装置:可用来证明碳的非金属性比硅强
B.乙装置:橡皮管的作用是能使水顺利流下
C.丙装置:用图示的方法不能检查此装置的气密性
D.丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应均伴随着能量的变化,某化学反应过程能量变化如图所示,该化学反应可能是

A.NaOH+HCl=NaCl+H2O
B.Fe+H2SO4=FeSO4+H2↑
C.2Na2O2+2H2O=4NaOH+O2↑
D.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NH3通入50 mL NH4Cl溶液中至pH=10,再向其中滴加1 mol/L盐酸。溶液的pH随加入盐酸体积的变化如下图所示。

下列说法不正确的是
A.a点溶液中,c(OH-)=l×l0-4 mol/LB.b点溶液中,c(NH4+)>c(Cl-)
C.c点时,加入的n(HCI)小于通入的n(NH3)D.a→b,水的电离程度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前四周期,请回答有关问题:(相关问题均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)④的原子结构示意图为_________;②在元素周期表位置________;上述元素中最高价氧化物的水化物酸性最强的是_________;(填水化物化学式)
(2)⑤的最高价氧化物的水化物和⑥的最高价氧化物反应的离子方程式________________
(3)用电子式表示元素①和⑧形成的化合物的形成过程________________
(4)⑤的最高价氧化物水化物的电子式________________
(5)请设计实验证明⑧与⑩的氧化性强弱________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com