
【题目】下表是元素周期表的前四周期,请回答有关问题:(相关问题均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)④的原子结构示意图为_________;②在元素周期表位置________;上述元素中最高价氧化物的水化物酸性最强的是_________;(填水化物化学式)
(2)⑤的最高价氧化物的水化物和⑥的最高价氧化物反应的离子方程式________________
(3)用电子式表示元素①和⑧形成的化合物的形成过程________________
(4)⑤的最高价氧化物水化物的电子式________________
(5)请设计实验证明⑧与⑩的氧化性强弱________________
【答案】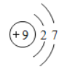 第二周期第ⅣA族 HClO4 Al2O3 + 2OH- = 2AlO2 -+ H2O
第二周期第ⅣA族 HClO4 Al2O3 + 2OH- = 2AlO2 -+ H2O ![]()
![]() 将Cl2通入NaBr溶液中,溶液变橙黄色,说明Cl2置换出溴,从而证明Cl的氧化性强于Br
将Cl2通入NaBr溶液中,溶液变橙黄色,说明Cl2置换出溴,从而证明Cl的氧化性强于Br
【解析】
根据元素在元素周期表中的位置可知①为H元素,②为C元素,③为N元素,④为F元素,⑤为Na元素,⑥为Al元素,⑦为S元素,⑧为Cl元素,⑨为K元素,⑩为Br元素。
(1)④为F元素,F是9号元素,原子结构示意图为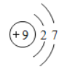 ;②为C元素,是第6号元素,周期表中位于第二周期第ⅣA族;最高价氧化物的水化物酸性越强,非金属性越强,表中非金属性最强的是F,但F没有最高价含氧酸,所以剩余元素中Cl元素非金属性最强,其最高价氧化物HClO4是酸性最强的含氧酸;
;②为C元素,是第6号元素,周期表中位于第二周期第ⅣA族;最高价氧化物的水化物酸性越强,非金属性越强,表中非金属性最强的是F,但F没有最高价含氧酸,所以剩余元素中Cl元素非金属性最强,其最高价氧化物HClO4是酸性最强的含氧酸;
(2)⑤的最高价氧化物的水化物是NaOH,⑥的最高价氧化物是Al2O3,反应方程式为:Al2O3+ 2OH- = 2AlO2 -+ H2O;
(3)H与Cl形成的HCl是共价化合物,其形成过程可表示为:![]() ;
;
(4)⑤的最高价氧化物水化物是NaOH,为离子化合物,其电子式为![]() ;
;
(5)比较Cl与Br的氧化性强弱可以通过置换反应,Cl2能将NaBr中的Br2置换出来,则证明Cl的氧化性强于Br;


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)灯泡寿命是普通灯泡的100倍,而耗能即为10%,推广砷化镓(GaAs)、 氮化镓(GaN)等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:
(1)基态N原子核外电子排布图为 _____________________ ;Ga与Al同主族,且位于Al的下一周期,则基态Ga原子的价电子排布式为 ________________。
(2)Ga的电负性比As______(填“大”或“小”);Ga逐级失去电子的电离能 (单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知Ga的主要化合价为__和+3。
(3)比较下列Ga的卤化物的熔点和沸点, GaCl3、GaBr3、GaI3的熔、沸点依次升高, 分析其变化的原因是:_____________________________________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是____________________________。
(4)GaAs是将(CH3)3Ga和AsH3用金属有机物化学气相淀积方法制备得到,该反应在700℃下进行
①则该反应的化学方程式为:____________________________________________。
②反应物AsH3分子的几何构型为________________,(CH3)3Ga中镓原子杂化方式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨是富氢物质,是氢能的理想载体。下列说法不正确的是( )
A. NH3分子中氮原子的杂化方式为sp3杂化
B. [Cu(NH3)4]2+中,NH3分子是配体
C. 相同压强下,NH3的沸点比PH3的沸点低
D. NH4+与PH4+、CH4、BH4-互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率![]() x
x
A. ![]() (O2) = 0.01mol·(L·s) –1 B.
(O2) = 0.01mol·(L·s) –1 B. ![]() (NO) = 0.008mol·(L·s) –1
(NO) = 0.008mol·(L·s) –1
C. ![]() (H2O) = 0.006mol·(L·s) –1 D.
(H2O) = 0.006mol·(L·s) –1 D. ![]() (NH3) = 0.002mol·(L·s) –1
(NH3) = 0.002mol·(L·s) –1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下8种化合物中,不能通过化合反应直接生成的有
①Fe3O4 ②Fe(OH)3 ③FeCl2 ④Cu2(OH)2CO3 ⑤Al(OH)3 ⑥Na2CO3 ⑦NaHCO3 ⑧Na2O2
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
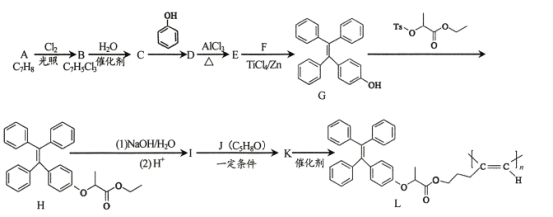
【题目】聚合物L具有特殊的光学性质,可用于光电材料,其合成路线如下:
已知:
i.有机物可用键线式表示,如![]() 可表示为
可表示为
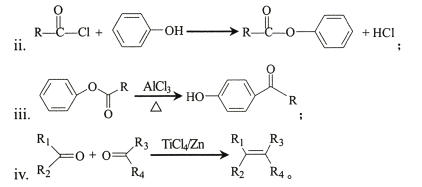
(1) A—B的化学方程式为____。
(2)D的结构简式为____。
(3)E中含有的含氧官能团为____ 。
(4) G—H的反应类型为____。
(5)I—K的化学方程式为____。
(6)下列说法正确的是______填字母序号)。
a.A分子中所有碳原子均在同一平面 b.C的结构简式为![]()
c.F+F—G的副产物中有2种互为顺反异构体 d.1 mol H最多能与2 molNaOH反应
(7)乳酸乙酯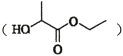 是合成
是合成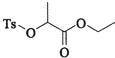 的中间体。下图是某同学设计的合成乳酸乙酯的流程。
的中间体。下图是某同学设计的合成乳酸乙酯的流程。
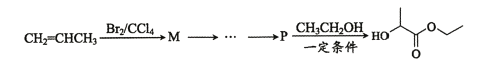
请写出M-P的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列各方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
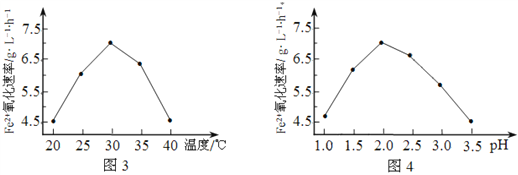
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将5.6 g铁粉投入100 mL 2 mol·L-1稀硫酸中,2 min时铁粉恰好完全溶解。关于该反应的速率,四位同学提出了四种表示方法:
甲:v(Fe)=2.8 g·min-1;乙:v(H2SO4)=1 mol·L-1·min-1;丙:v(FeSO4)=0.5 mol·L-1·min-1; 丁:v(H2)=1.12 L·min-1。
下列说法正确的是( )
A.甲错误,因为固体物质不能用来表示反应速率
B.丁错误,因为速率的单位错误
C.只有乙错误
D.只有丙正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是
A.硝酸银溶液与盐酸反应:Ag++HCl=AgCl↓+H+
B.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
C.氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
D.铜与浓硝酸反应:Cu+4H++2![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com