
【题目】写化学方程式或离子方程式
①实验室制NH3的化学方程式:_______________________________
②MnO2与浓盐酸加热的离子方程式:____________________________
③Fe与高温H2O(g)的化学方程式:____________________________
④Cu与稀HNO3的离子方程式:_____________________________
【答案】2NH4Cl+Ca(OH)2 ![]() CaCl2+2 NH3↑+2H2O MnO2+4H++2Cl-
CaCl2+2 NH3↑+2H2O MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 3Fe+4 H2O(g)
Mn2++Cl2↑+2H2O 3Fe+4 H2O(g) ![]() Fe3O4+4H2↑ 3Cu+ 8H+ +2NO3- = 3Cu2+ + 2NO↑ +4H2O
Fe3O4+4H2↑ 3Cu+ 8H+ +2NO3- = 3Cu2+ + 2NO↑ +4H2O
【解析】
①实验室用氯化铵和氢氧化钙加热制备NH3;
②MnO2与浓盐酸加热生成氯化锰、氯气、水;
③Fe与高温H2O(g)反应生成四氧化三铁和氢气;
④Cu与稀HNO反应生成硝酸铜、一氧化氮、水;
①实验室用氯化铵和氢氧化钙加热制备NH3,反应方程式是2NH4Cl+Ca(OH)2![]() CaCl2+2 NH3↑+2H2O;
CaCl2+2 NH3↑+2H2O;
②MnO2与浓盐酸加热生成氯化锰、氯气、水,反应的离子方程式是MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
③Fe与高温H2O(g)反应生成四氧化三铁和氢气,反应的化学方程式是3Fe+4 H2O(g) ![]() Fe3O4+4H2↑;
Fe3O4+4H2↑;
④Cu与稀HNO反应生成硝酸铜、一氧化氮、水,反应的离子方程式是3Cu+ 8H+ +2NO3- = 3Cu2+ + 2NO↑ +4H2O。


科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物K是治疗急、慢性支气管炎及支气管扩张、肺气肿、肺结核等疾病药物的中间体,其合成路线如下,回答下列问题:
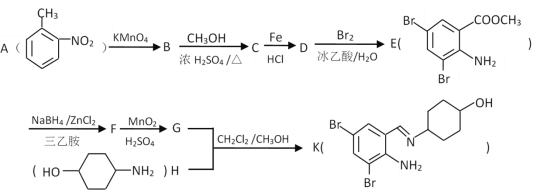
已知信息:
① 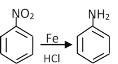
②![]()
③R1CHO+R2NH2 →R1CH=NR2
(1)B→C的反应类型为____________, H中官能团的名称为__________________。
(2)G的结构简式为______________,F→G的反应类型为_______________。
(3)D→E的反应方程式为___________________________________________。
(4)写出化合物D同时符合下列条件的同分异构体的结构简式_____________。
①苯环上有两个取代基,官能团与D相同,苯环上的一氯代物有两种
②核磁共振氢谱显示峰面积比为2:2:2:3
(5)已知:通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。写出以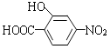 和
和![]() 为原料制备
为原料制备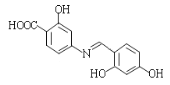 的合成路线______________________(其他试剂任选)。
的合成路线______________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验内容能达到实验目的的是
实验目的 | 实验内容 | |
A | 鉴别乙醇与乙醛 |
|
B | 比较乙酸、碳酸、苯酚的酸性 |
|
C | 说明烃基对羟基上氢原子活性的影响 | |
D | 说明苯环对取代基上氢原子活性的影响 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,某容器充满N2重114g,若充满CO2重122g,现充满某气体重108g,则某气体的相对分子质量为
A.28B.32C.44D.16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素中砹元素位于碘的后面,根据元素周期律推测砹及化合物最不可能具备性质( )
A.砹单质易溶于四氯化碳中B.砹化氢很不稳定易分解
C.砹单质在常温常压下是有色气体D.砹化银不溶于水或稀![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
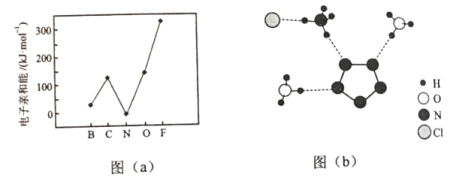
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B. 中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N5—中的大π键应表示为____________。
),则N5—中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)NH…Cl、____________、____________。
(4)R的晶体密度为d g·cm3,其立方晶胞参数为a nm,晶胞中含有y个单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com