
【题目】下列有关2个电化学装置的叙述正确的是( ) 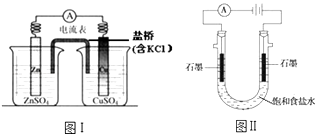
A.图Ⅰ,电流形成的完整过程是:负极Zn﹣2e﹣═Zn2+ , 电子经导线流向正极,正极Cu2++2e﹣═Cu
B.图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4 , 用石墨替换Cu棒
C.图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e﹣═H2↑
D.图Ⅱ,通电后,由于OH﹣向阳极迁移,导致阳极附近pH升高
【答案】B
【解析】解:A、活泼金属锌失去电子,电极反应式为:Zn﹣2e﹣═Zn2+ , 电子沿导线流向正极,正极Cu2++2e﹣═Cu,内电路离子的定向移动,构成闭合回路,才是电流形成的完整过程,故A错误; B、Na2SO4替换ZnSO4 , 负极仍是锌放电,原电池中的铜本身未参与电极反应,所以可用能导电的石墨替换Cu棒,故B正确;
C、溶液中氢离子来源于水的电离,氢离子浓度很小,所以通电后Na+先从阳极区移动到阴极,阴极周围的水电离出氢离子在阴放电,故C错误;
D、阳极是氯离子放电,生成酸性气体氯气,氯离子放电结束后是水电离出的氢氧根离子放电,导致阳极附近pH降低,故D错误;
故选B.
A、活泼金属锌失去电子,电子沿导线流向正极,内电路离子的定向移动,构成闭合回路;
B、Na2SO4替换ZnSO4 , 负极仍是锌放电,原电池中的铜本身未参与电极反应;
C、溶液中氢离子来源于水的电离,氢离子浓度很小;
D、阳极是氯离子放电,生成氯气,氯离子放电结束后是水电离出的氢氧根离子放电.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 向氯化铝溶液中加入过量氨水:Al3++4NH3H2O=AlO2﹣+4NH4++2H2O
B. 明矾净水的原理是明矾溶于水后电离出的Al3+水解生成Al(OH)3胶体:Al3+ + 3H2O = Al(OH)3↓+ 3H+
C. 向硫酸铁溶液中滴加硫氰化钾溶液:Fe3++3SCN﹣=Fe(SCN)3↓
D. 向酸性FeCl2溶液中加入H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
A.平衡向正反应方向移动了
B.平衡向逆反应方向移动了
C.物质B的质量分数增加了
D.a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知蛋白质含有C、H、O、N等元素。下列关于自然界中氮循环的说法错误的是
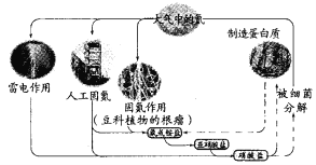
A. 含氮无机物和含氮有机物可相互转化
B. 碳、氢、氧三种元素也可能参与了氮循环
C. 铵盐转化为硝酸盐,发生了还原反应
D. 目前人工固氮的反应为N2+3H2![]() 2NH3
2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+B(g)2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示. 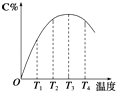
①由T1向T2变化时,正反应速率逆反应速率(填“>”、“<”或“=”).
②由T3向T4变化时,正反应速率逆反应速率(填“>”、“<”或“=”).
③反应在温度下达到平衡.
④此反应的正反应为热反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②、③中红色均不褪去。下列分析错误的是

A. 过氧化钠与水反应产生的气体为O2
B. 过氧化钠与水反应需要MnO2作催化剂
C. 实验②、③证明使酚酞褪色的不是氢氧化钠和氧气
D. 过氧化钠与水反应可能生成了具有漂白性的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生如下反应:3A+B2C (A、B、C均为气体),若最初加入的A、B都是4mol,10s内用A表示的平均反应速率为0.12mol/(Ls),则10s后容器中的B的物质的量是( )
A.2.8 mol
B.1.6 mol
C.3.2 mol
D.3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝与过量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A.降低温度
B.加入适量的水
C.加入少量CuSO4溶液
D.加入浓度较大的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有一白色固体粉末,可能含有NaCl、Na2SO4、Na2CO3、KNO3、BaCl2和CuSO4中的一种或几种,按以下步骤进行实验:
①将该固体粉末放入足量水中得到无色溶液和白色不溶物。
②过滤,在不溶物中加入足量稀盐酸,有气泡产生。充分反应后仍有不溶物存在。
③取②的滤液于试管中.加入Cu粉,微热,一段时间后试管口出现红棕色。
根据以上实验现象判断:
(1)混合物中一定没有____;可能有_______。(均填化学式)
(2)写出②中反应的化学方程式: _____________
(3)写出③中溶液里反应的离子方程式:__________
Ⅱ.A、B、C、X是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去)。请回答下列问题:
![]()
(1)若X是强氧化性单质,则A不可能是_________(填序号)。
a.C b.N2 c.S d.Mg e.Al
(2)若A能使湿润的紅色石蕊试纸变蓝,C为红棕色的气体。A转化为B的化学方程式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com