
【题目】元素①~⑩在周期表中的位置如表所示,试回答下列问题。
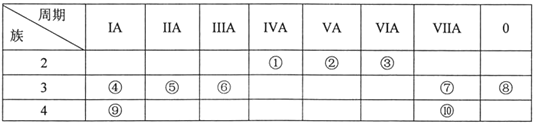
(1)上述10种元素中,化学性质最不活泼的是___(填元素符号,下同);与水反应最激烈的金属元素是___。
(2)元素①最高价氧化物的结构式是___;元素②的简单气态氢化物的电子式是___;上述10种元素中,其最高价氧化物对应水化物的酸性最强的物质是___(填化学式)。
(3)①②⑤元素的原子半径由小到大的顺序为___(用元素符号表示);
(4)请用一个化学方程式(或离子方程式)说明元素⑦和⑩非金属性的强弱:___。
(5)④和⑥两元素的最高价氧化物对应的水化物相互反应的离子方程式:___。
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是___。
A.比较两种元素的单质的熔点、沸点高低
B.将打磨过的形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
C.比较两种元素的最高价氧化物对应的水化物碱性强弱
【答案】Ar K O=C=O 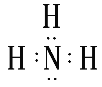 HClO4 N<C<Mg 2Br-+Cl2=Br2+2Cl- Al(OH)3+OH-=AlO2-+2H2O BC
HClO4 N<C<Mg 2Br-+Cl2=Br2+2Cl- Al(OH)3+OH-=AlO2-+2H2O BC
【解析】
根据所给元素周期表,①为C元素,②为N元素,③为O元素,④为Na元素,⑤为Mg元素,⑥为Al元素,⑦为Cl元素,⑧为Ar元素,⑨为K元素,⑩为Br元素,据此分析。
(1)稀有气体元素的化学性质不活泼,故这10种元素中Ar的化学性质最不活泼;金属元素的金属性越强,其与水反应越剧烈,这10种元素中K的金属性最强,故K与水反应最剧烈;
(2)C元素的最高价氧化物为CO2,其结构为O=C=O;N元素的气态氢化物为NH3,其电子式为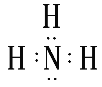 ;元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,故这10种元素中酸性最强的是HClO4;
;元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,故这10种元素中酸性最强的是HClO4;
(3)三种元素原子,Mg的半径比Be大,Be的半径比C大,C的半径比N大,故Mg、C、N三种元素的半径从小到大为N<C<Mg;
(4)由于Cl的非金属性较强,故Cl2可以和Br-发生反应生成Br2和Cl-,离子方程式为2Br-+Cl2=Br2+2Cl-;
(5)NaOH和Al(OH)3发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
(6)根据单质的熔、沸点不能比较元素的金属性,A错误;根据单质与水反应的现象可以比较元素的金属性,B正确;根据两种元素的最高价氧化物对应的水化物碱性可以比较元素的金属性,C正确;故答案为BC。


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2L的密闭容器中,将2molM气体和3molN气体混合,发生下列反应:2M(g) + 3N(g)![]() xQ(g) + 3R(g),该反应达到平衡时生成2.4molR,并测得Q浓度为0.4 mol·L-1,下列叙述正确的是
xQ(g) + 3R(g),该反应达到平衡时生成2.4molR,并测得Q浓度为0.4 mol·L-1,下列叙述正确的是
A. X值为2 B. 容器内压强不变
C. 平衡时N的浓度为0.6mol/L D. M的转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次 增大。在如图所示的物质转化关系中,p、q、 m.n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol L -1 ,t 溶液与 0.1 mol L -1 u 溶液的pH均为1。下列说法不正确的是
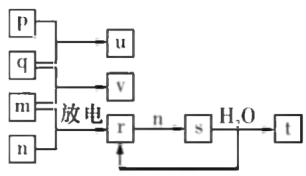
A.Y、W的兹高价氧化物对应的水化物均为强酸
B.元索的非金属性:Z>Y>X;原子半径:X<Z<Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.的电子式可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钨(WS,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2()3)制备二硫化钨的工艺流程如图所示,下列说法正确的是
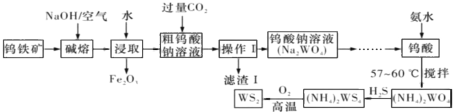
A.操作I中用到的玻璃仪器只有漏斗、烧杯
B.FeWO4在碱熔过程中发生反应的化学方程式为4FeWO4+O2+8NaOH![]() 2Fe2O3+4NaWO3+4H2O
2Fe2O3+4NaWO3+4H2O
C.生成二硫化钨的化学方程式为(NH4)2WS4+3O2![]() 2WS2+4NH3+2S2-+2SO2+2H2O,若生成124g WS2,则该反应所转移的电子数目为2NA
2WS2+4NH3+2S2-+2SO2+2H2O,若生成124g WS2,则该反应所转移的电子数目为2NA
D.滤渣I的主要成分是氢氧化铝,CO2可以用过量盐酸代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的容器中,对于反应 A(g)+2B(g)![]() 3C(g)(正反应为吸热反应),下列叙述为平衡状态标志的是
3C(g)(正反应为吸热反应),下列叙述为平衡状态标志的是
①体系的温度不再变化 ②外界条件不变时,A、B、C浓度保持不变 ③气体平均分子量不再变化 ④体系的压强不再变化 ⑤气体密度不再变化 ⑥3 v正(B)=2 v逆(C) ⑦单位时间内消耗1 mol A(g)的同时生成3 mol C(g)
A.①②⑥B.①②③⑤C.②③④⑤D.①②④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取6根铁钉,6支干净的试管及其他材料,如图所示。
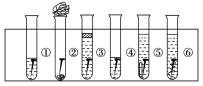
试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触;
试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触;
试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片;
试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。
(1)上述实验中铁钉发生了电化学腐蚀的是____(填试管序号);在电化学腐蚀中,负极反应是____,正极反应是______。
(2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是_________。
(3)为防止铁的锈蚀,工业上普遍采用的方法是____________(答两种方法)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为某种胃药的核心合成反应部分过程:

下列说法正确的是( )
A.甲中的两个![]() 键的活性相同B.乙所有原子在同一平面上
键的活性相同B.乙所有原子在同一平面上
C.丙的分子式![]() D.该反应生成丙的原子利用率小于100%
D.该反应生成丙的原子利用率小于100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com