
短周期元素X、Y、Z在元素周期表中的相对位置如图所示,其中X原子最外层电子数是次外层电子数的3倍。下列说法错误的是

A.元素X和元素Y的最高正化合价相同
B.气态氢化物的热稳定性:H2 Y < H2 X
C.Y2 Z2是共价化合物
D.酸性:HZO4 >H2YO4
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
下列关于各实验装置与对应现象或结论的叙述均正确的是

A.图1装置:可用于分离石油,分别得到汽油、煤油和柴油等各种纯净物
B.图2装置:可用于吸收NH3或HCl气体,并防止倒吸
C.图3装置:如果“a进b出”可用于收集NO2,如果“b进a出”可用于收集NH3
D.图4装置:持续通入CO2气体,现象是先出现白色沉淀,后变澄清
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高三上学期期末理综化学试卷(解析版) 题型:选择题
【化学——选修3物质结构与性质】(15分)已知A、B、C、D、E、F为前四周期的六种元素,原子序数依次增大,其中A位于周期表的s的区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn,B和E同主族,D原子的最外层电子数是其内层的3倍;F元素位于元素周期表的第四行、第十一列。试回答下列问题:
(1)基态F原子的核外电子排布式为 。
(2)关于B2A2的下列说法中正确的是____ (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中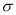 键和
键和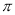 键数目比为1:1
键数目比为1:1
③B2A2是由极性键和非极性键构形成的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为 (用元素符号表示)。
(4)C的气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型
有____ (填选项序号)。
①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键
(5)基态E原子的最高能层具有的原子轨道数为____ ;B和E分别与氧元素形成的最高价氧化物中,熔沸点较高的是 (写化学式);
(6)F单质的晶体堆积方式为面心立方,其配位数为 ;若F的相对分子质量为M,它的晶胞棱长为a(cm),则F晶体的密度为 g·cm-3。(阿伏伽德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
高铁酸钾(K2FeO4)是一种兼具净水和消毒功能的可溶性盐,可发生如下反应:
2K2FeO4+16HCl=4KCl+2FeCl3+8H2O+3Q↑,下列说法正确的是
A.可用湿润的淀粉碘化钾试纸检验产物Q
B.K2FeO4在水中的电离方程式为K2FeO4=2K++Fe6++4O2一
C.反应中氧化剂与还原剂的物质的量之比为1:8
D.反应中涉及的6种物质均为电解质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
将反应Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是
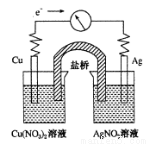
A.KNO3盐桥中的K+移向Cu(NO3)2溶液
B.Ag作负极,Cu作正极
C.工作一段时间后,Cu(NO3)2溶液中c(Cu2+)增大
D.取出盐桥后,电流计的指针依然发生偏转
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
下列说法正确的是
A.14C、14N互为同位素
B.H2 O、CH3COOH、NH4 HCO3都属于电解质
C.铝、铁、铜对应的氧化物均为碱性氧化物
D.金属阳离子被还原时一定得到金属单质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:选择题
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通人 SO2气体,溶液逐渐变成无色。下列分析正确的是
A.滴加KI溶液时,转移2 mol e-时生成 1 mol白色沉淀
B.通入SO2后溶液逐渐变成无色,体现了 SO2的漂白性
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+ >I2 > SO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24 L SO3含有分子的数目为0.1NA
B.1 mol O2与Na完全反应,转移电子数一定为4NA
C.常温常压下,1.6 g CH4中含有共价键的数目为0.4NA
D.将2 mL 0.5 mol/L硅酸钠溶液滴入盐酸中制得硅酸胶体,所含胶粒数目为0.001NA
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省咸宁市高一上学期期末考试化学(B)试卷(解析版) 题型:选择题
离子方程式H+ + OH-= H2O可表示的化学方程式是
A.醋酸与氢氧化钠的反应 B.硫酸氢钠与氢氧化钠的反应
C.硫酸与氢氧化镁的反应 D.盐酸与氨水的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com