
����Ŀ����1���ء��������Ԫ�صĻ�����������������̫���ܵ�ص���Ҫ���ϡ���֪��SeO2�ڳ������ǰ�ɫ�ľ��壬�۵�Ϊ340-350�棬��SeO2��������____���壬SeO2��Seԭ�Ӳ�ȡ���ӻ�����Ϊ_____________����2��±�ص��ʼ��仯�����ڹ�ũҵ�����������ж�����Ҫ����;��
��ͬ����Ԫ�صĵ縺�Դ�С����һ���Ĺ��ɣ�±��Ԫ��(F��CI��Br��I)�У��縺���С����____����̬Brԭ�ӵļ۵����Ų�Ϊ___________________��
����Ԫ�ؾ���ȱ�����ԣ��۵��������ڼ۲����������仯���������й¶Ե��ӵķ��ӻ���������������BF3����NH3��Ӧ����BF3��NH3��BF3���ӵķ��ӹ���Ϊ____��BF3-NH3��BF3��NH3֮��ͨ�����____������Ӽ���������λ���������������
��3��ij�����ǿ���ҩ���е�����Ԫ�أ��侧���н���ԭ�ӵĶѻ���ʽ����ͼ��ʾ��Mg/mol����ԭ�ӵ���λ��Ϊ___________��N��֪������Ħ������ΪMg��mol��ԭ�Ӱ뾶Ϊrpm�������ӵ�����ΪNA����þ������ܶ�Ϊ____g/cm3��(�ú�M��NA��r�Ĵ���ʽ��ʾ��lpm=1.0��10��10cm)

���𰸡� ���� sp2 I 4s24p5 ƽ���������� ��λ�� 12 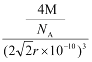
����������1��SeO2�ڳ������ǰ�ɫ�ľ��壬�۵�Ϊ340-350�����۵�ͣ�Ϊ���Ӿ��壬SeO2��Seԭ�Ӽ۲���Ӷ�= ![]() ��Seԭ�Ӳ�ȡ���ӻ�����Ϊsp2�ӻ���
��Seԭ�Ӳ�ȡ���ӻ�����Ϊsp2�ӻ���
��2����ͬ����Ԫ�صĵ縺�Դ��¶��µݼ�����F�ĵ縺�����I�ĵ縺����С����̬Brԭ�ӵļ۵����Ų�Ϊ4s24p5 ��
��BF3�����м۲���ӶԸ���=![]() ���Ҳ����µ��Ӷԣ����Ը÷�����ƽ�������νṹ��������BF3-NH3�У�Bԭ���ṩ�չ����ԭ�ӡ�Nԭ���ṩ�µ��Ӷԣ�����B��Nԭ��֮���γ���λ����
���Ҳ����µ��Ӷԣ����Ը÷�����ƽ�������νṹ��������BF3-NH3�У�Bԭ���ṩ�չ����ԭ�ӡ�Nԭ���ṩ�µ��Ӷԣ�����B��Nԭ��֮���γ���λ����
��3���ɾ���ͼ��֪���þ�����ԭ�ӵĶѻ���ʽΪ�����������ܶѻ�������λ��Ϊ12������߳�Ϊacm����a2+a2=(4r�w10-10)2, ![]() ������ԭ�Ӹ���Ϊ
������ԭ�Ӹ���Ϊ
![]() ����������Ϊm=
����������Ϊm=![]() ,���Ԧ�=
,���Ԧ�=![]() =
=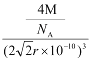 ��
��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǽ������ָʾ����ɫ��pH��Χ���ټ���3.1��4.4�ڼ���4.4��6.2�۷�̪8.2��10.0������0.1000mol��L-1��NaOH��Һ�ζ�Ũ�����������ʱ������ָʾ���� ��
A.��������B.ֻ���â�C.�����âٻ��D.�����âڻ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������Ϊ��������Ҫ������ϩ�����ƻ������顢�״������Ƽ�ȩ�ȡ�Ŀǰ���������г�������������ӵ����ơ���д���״����������Ʊ���ȩ�Ļ�ѧ����ʽ
________________________________________________________________��
��2����������ʹ�ù����У�������������ѡ���Խ��ͣ�һ��ʱ�����������ij������ʧЧ���������л��ղ�ʵ�������������������£�

��֪����������Ҫ�ɷ֣�X����ӫ�����������
Ԫ�� | Al2O3 | Ag | MgO | SiO2 | K2O | Fe2O3 |
����% | 82 | 14.8 | 1.4 | 0.9 | 0.5 | 0.1 |
���ϣ���X���������Ǽ�⣬�����������ľ���Ϊ���ͣ������ᡣ
�ٲ���a�Ͳ���b��������_________��
����д�����̢�������ϡ���ᷴӦ�����ӷ���ʽ
________________________________________________________________��
��3����Һ2 �к��ж��ֽ������ӣ��������������K+��ʵ�鷽��
____________________________________________________________________��
��4����ϻ�ѧ�����ƽ���ƶ��ǶȽ����̢����ð�ˮ���Ȼ��������ܽ��ԭ
��_______________________________________________________________��
��5�����̢������£�N2H4����Ϊ��ԭ�������в�����������ʡ���ԭ��ǿ���õ������ȸߵ��ŵ㣬�ù��̵Ļ�ѧ����ʽΪ��
________________________________________________________��
��6�����ù��̢�ʵ�������������������װ��ͼ���£�

д�����������ĵ缫��Ӧʽ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л��������ϵͳ��������ȷ����( )
A.2������3���嶡��
B.2������3����Ȳ
C.2������1����ϩ
D.4���һ���2���촼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������彡����ɽϴ�Σ������
A. ʹ��SO2Ư������
B. ����ˮ��ͨ������Cl2��������ɱ��
C. ��ʳ����ϴ��ˮƿ���ڱڸ��ŵ�ˮ��
D. ��С�մ��Ƹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ��д��ȷ���ǣ�������
A. NaHCO3�TNa++H++CO32�� B. NaHSO4�TNa++H++SO42��
C. Fe2��SO4��3�TFe3++SO42�� D. NH3H2O�TNH4++OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ʵ�鷽��,�Է���KCl��BaCl2���ֹ�������,�Իش�����������

��ѡ�Լ���Na2SO4��Һ��K2CO3��Һ��K2SO4��Һ�����ᡣ
(1)��������������_________��
(2)�Լ�a��_________,�Լ�b ��_________ ��
(3)�����Լ�a��������Ӧ�����ӷ���ʽΪ_________��
�����Լ�b��������Ӧ�����ӷ���ʽΪ_________��
(4)�÷����ܷ�ﵽʵ��Ŀ��:_____(������������������)��������,Ӧ��θĽ�? _____������,���ʲ��ûش�).
(5)��Ҫ�ⶨԭ�������BaCl2����������������Ҫȷ���������������⡣���ٻ�Ҫ��õ�������_________��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Ԫ�����ڱ��С����ڡ���˵���������
A. Ԫ�����ڱ������ĸ������ڡ�����������
B. ͬһ��������Ԫ��ԭ�ӵĺ�����Ӳ�����ͬ
C. ͬһ��������Ԫ��ԭ�ӵļ۵�����Ŀ��ͬ
D. Ԫ�����ڱ���ÿ�����ھ��ӽ���Ԫ�ؿ�ʼ���Էǽ���Ԫ�ؽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ĺ�ҵԭ�ϡ�
��.ʵ���ҿ��ö������̺�Ũ���ᷴӦ��ȡ��������Ӧ�Ļ�ѧ����ʽ��________��
��.ij�о���ѧϰС��������ϵ�֪��Ư�������ᷴӦ����ȡ��������ѧ����ʽΪ��Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2��+2H2O�������ø÷�Ӧ���������ȡ��������֤�����ʵ�ʵ�顣
2CaSO4+2Cl2��+2H2O�������ø÷�Ӧ���������ȡ��������֤�����ʵ�ʵ�顣

�ش��������⣺��1����ʵ����A���ֵ�װ����_______(����)��
��2����������������һ��ʵ�飬֤��ϴ��ƿC�е�Na2SO3�ѱ�����(����ʵ�鲽��)��_____________________________��
��3��д��Dװ���з�����Ӧ�����ӷ���ʽ_________________
��4����ʵ��������Ե�ȱ�ݣ���������Ľ��ķ���__________________________________________д����Ӧ���ӷ���ʽ_____________________________________��
��5����С���ֽ���������ʵ�飺��ȡƯ��2.0 g����ĥ���ܽ⣬���Ƴ�250 mL��Һ��ȡ��25 mL���뵽��ƿ�У��ټ��������KI��Һ������H2SO4��Һ�����á�����ȫ��Ӧ����0.1 mol.L1��Na2S2O3��Һ����Һ�ζ���Ӧ���ɵĵ⣬��֪��Ӧ����ʽΪ��2Na2S2O3+I2===Na2S4O6+2NaI������ȥNa2S2O3��Һ20.0 mL�����Ư����Ca(ClO)2����������Ϊ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com