
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式__________
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称"同系物"),它们均符合通式CnH2n+2。当n=______时,这类有机物开始出现同分异构体。
(3)B具有的性质是__________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式__________
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为____;其化学方程式为__________
【答案】CH2=CH2+Br2→CH2Br—CH2Br 4 ②③ ![]() +HO—NO2
+HO—NO2![]()
![]() +H2O 酯化反应(取代反应) CH2=CH-COOH+C2H5OH
+H2O 酯化反应(取代反应) CH2=CH-COOH+C2H5OH![]() CH2=CH-COO2H5+H2O
CH2=CH-COO2H5+H2O
【解析】
A使溴的四氯化碳溶液褪色,含有不饱和键,结合其比例模型可知A为CH2=CH2,A能与水在一定条件下反应生成C,C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,C为CH3CH2OH,根据B的组成元素及其球棍模型知B是苯,D和C反应生成相对分子质量为100的酯,说明D含有羧基,结合D的球棍模型可知D为CH2=CHCOOH,结合有机物的性质来解答。
(1)由分析可知A为CH2=CH2,与溴的四氯化碳溶液发生加成反应,化学方程式为:CH2=CH2+Br2→CH2Br—CH2Br,答案为:CH2=CH2+Br2→CH2Br—CH2Br;
(2) A为CH2=CH2,CH2=CH2与氢气发生加成反应后生成的E为乙烷(C2H6),烷烃的通式为CnH2n+2,在烷烃的同系物里,甲烷、乙烷、丙烷没有同分异构体,从丁烷开始出现同分异构体,丁烷有正丁烷和异丁烷两种同分异构体,答案为:4;
(3)由分析可知B是苯,苯是无色有特殊气味的、不溶于水且密度小于水的有毒液体,和酸性KMnO4溶液和溴水都不反应,在催化剂条件下可与氢气发生加成反应,②③正确;在浓硫酸作用下,苯与浓硝酸在加热条件下发生取代反应生成硝基苯,反应的方程式为![]() +HO—NO2
+HO—NO2![]()
![]() +H2O,答案为:②③;
+H2O,答案为:②③;![]() +HO—NO2
+HO—NO2![]()
![]() +H2O;
+H2O;
(4) C与D分别为CH3CH2OH和CH2=CHCOOH,二都反应能生成相对分子质量为100的酯,该反应的反应类型为酯化反应,酯化反应也属于取代反应,羧酸和醇在发生酯化反应时,羧酸失去羧基里的羟基,醇失去羟基里的氢原子,C与D反应的化学方程式为:CH2=CH-COOH+C2H5OH![]() CH2=CH-COO2H5+H2O,答案为:酯化反应(取代反应);CH2=CH-COOH+C2H5OH
CH2=CH-COO2H5+H2O,答案为:酯化反应(取代反应);CH2=CH-COOH+C2H5OH![]() CH2=CH-COO2H5+H2O。
CH2=CH-COO2H5+H2O。


科目:高中化学 来源: 题型:
【题目】(1)向0.01 mol/L的NH4Cl溶液中分别加入少量的KOH固体、浓盐酸、FeCl3固体、Na2CO3固体,使NH4+水解平衡移动的方向分别为_____、_____、_____、____(填“右”“左”或“不移动”)
(2)写出Na2CO3溶液中的三大守恒规律
电荷守恒:_____________________;
物料守恒:_____________________;
质子守恒:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质X的产量通常用来衡量一个国家的石油化工水平。以X为主要原料合成重要的有机化合物路线如下图所示,请回答下列问题。

(1)X所含官能团的名称是______________,A物质所含官能团的名称是________。
(2)反应③的化学方程式是_______________,以乙烯为原料可合成有机高分子化合物D,反应①的化学方程式是____________________,该反应属于______反应(填有机反应类型)。
(3)下列物质中,不能通过乙烯加成反应得到的是________(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
(4)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是______。
②实验开始时,试管b中的导管不伸入液面下的原因是______。
③反应结束后,将试管b中的混合液经过____(填写实验分离操作)可得到纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
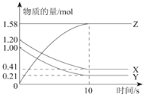
A.反应的化学方程式为: X(g)+Y(g)![]() Z(g)
Z(g)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.温度、体积不变,10s时充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. pH=1的H3PO4溶液中,含有0.1NA个H+
D. 10 g的D2O中含有的质子数与中子数分别为5NA和4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A.NaHCO3在水中的电离方程式:NaHCO3 = Na++HCO![]()
B.氯化镁溶液与氨水反应的离子方程式:Mg2++2OH-= Mg(OH)2↓
C.Cl2与水反应的离子方程式:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
D.醋酸钠水解的离子方程式CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向铜片中加入某浓度的硫酸120ml,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500ml。再加入足量锌粉,使之充分反应,收集到标准状况下氢气2.24L,过滤残留固体,干燥后称量,质量减轻了7.50g。求:
(1)溶解的铜的质量。______
(2)原硫酸的物质的量浓度。(要求写出简要计算过程)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于测定1mol氢气体积的操作中错误的是( )
A. 镁带称量后,用砂皮擦去表面的氧化层B. 保证装置不漏气
C. 用针筒注入硫酸后,拔出速度要快D. 镁带的质量要使产生的氢气足以计量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变某醋酸溶液的pH,溶液中c(CH3COO-)与c(CH3COOH)之和始终为0.1mol·L-1,溶液中H+、OH-、CH3COO-及CH3COOH浓度的常用对数值(lgc)与pH的关系如图所示。下列说法错误的是( )

A.图中③表示lgc(H+)与pH的关系曲线
B.0.1mol·L-1CH3COOH溶液的pH约为2.88
C.lgK(CH3COOH)=4.74
D.向0.10mol·L-1醋酸钠溶液中加入0.1mol醋酸钠固体,水的电离程度变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com