
【题目】向铜片中加入某浓度的硫酸120ml,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500ml。再加入足量锌粉,使之充分反应,收集到标准状况下氢气2.24L,过滤残留固体,干燥后称量,质量减轻了7.50g。求:
(1)溶解的铜的质量。______
(2)原硫酸的物质的量浓度。(要求写出简要计算过程)_______
【答案】64g 17.5mol·L-1(过程见解析)
【解析】
根据反应方程式,判断反应的类型,根据气体的体积和固体质量的变化计算参加反应的铜和锌以及硫酸的物质的量,注意利用质量守恒定律。
(1)Cu溶解于浓硫酸发生反应的化学方程式为Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,在反应后的混合液中加入Zn发生的反应包括:Zn+CuSO4=ZnSO4+Cu和Zn+H2SO4=ZnSO4+H2↑;已知n(H2)=![]() =0.1mol,产生氢气的Zn是0.1mol,质量是6.5g,m=7.5g-6.5g=1.0g即与铜的置换反应是损失1.0g,
=0.1mol,产生氢气的Zn是0.1mol,质量是6.5g,m=7.5g-6.5g=1.0g即与铜的置换反应是损失1.0g,
Zn+CuSO4=ZnSO4+Cu m
65 64 1
65g 64g 1.0g
∴m(Cu)=64g;
(2)已知n(Cu)=1.0mol,则n(H2SO4)=1.0mol×2+0.1mol=2.10mol,
c(H2SO4)=![]() =17.5mol·L-1。
=17.5mol·L-1。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程:
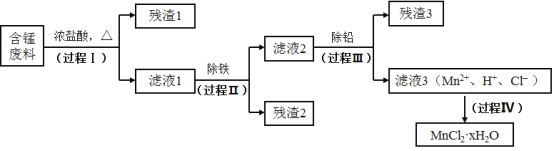
资料a.Mn的金属活动性强于Fe,Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是_____________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无蓝色沉淀生成;另取少量滤液1于试管中,_____________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.......
写出c的离子方程式:_____________。
(2)过程Ⅱ的目的是除铁。有如下两种方法:
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物......。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②补全ⅱ中的操作:_____________。
③两种方法比较,氨水法除铁的缺点是_____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是_____________。
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。则x=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol CH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101 kPa,120℃),其总质量为72 g,下列有关叙述不正确的是( )
A.产物的平均摩尔质量为24 g/mol
B.反应中消耗的氧气为56 g
C.若将产物通过浓硫酸充分吸收后恢复至(101 kPa,120℃),则压强变为原来的三分之一
D.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式__________
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称"同系物"),它们均符合通式CnH2n+2。当n=______时,这类有机物开始出现同分异构体。
(3)B具有的性质是__________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式__________
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为____;其化学方程式为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氨气燃料电池,如图所示,下列说法不正确的是
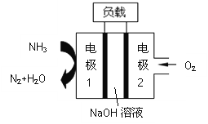
A.正极的电极反应式为O2+4e-+4H+=2H2O
B.电子流向:电极1→负载→电极2
C.Na+由左向右移动
D.NH3在电极1上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。如CH3-CH=CH-CH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为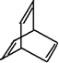 。下列说法不正确的是
。下列说法不正确的是
A. X的化学式为C8H8
B. 有机物Y是X的同分异构体,且属于烃,则Y的结构简式可能为![]()
C. X能使酸性的高锰酸钾溶液褪色
D. X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是
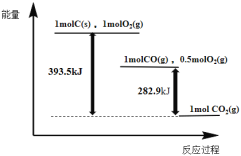
A.1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ
B.由C→CO的热化学方程式为:2C(s)+O2(g) = 2CO(g) ΔH= 221.2 kJmol1
C.反应2CO(g)+O2(g) =2CO2(g)中,生成物的总能量大于反应物的总能量
D.将1 mol C(s)磨成粉末后,反应更加剧烈,说明粉碎可以改变ΔH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出石英主要成分的化学式:_____________;写出异丁烷的结构简式:_____________
(2)联氨(又称为肼,分子式为N2H4)一种高能燃料,常备用于火箭、航天领域,通常用过量NH3与NaClO反应制得。
①请写出NH3的电子式:________________________
②肼溶于水显弱碱性,其原理与氨相似。请用电离方程式解释肼的水溶液显碱性的原因是:________
③请写出上述制备肼的化学方程式:______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】八十年代,我国化学家打破了西方国家对维生素C的垄断,发明的“两段发酵法”大大降低了生产成本。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
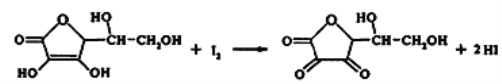
下列说法正确的是
A. 上述反应为取代反应
B. 维生素C水解得到2种产物
C. 维生素C有酯基不能溶于水,可溶于有机溶剂
D. 该反应表明维生素C具有还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com