
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程:
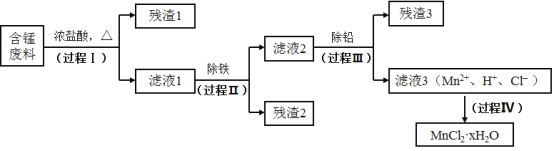
资料a.Mn的金属活动性强于Fe,Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是_____________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无蓝色沉淀生成;另取少量滤液1于试管中,_____________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.......
写出c的离子方程式:_____________。
(2)过程Ⅱ的目的是除铁。有如下两种方法:
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物......。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②补全ⅱ中的操作:_____________。
③两种方法比较,氨水法除铁的缺点是_____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是_____________。
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。则x=_____________。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 滴加KSCN溶液,变红 MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O或MnOOH+3H++Fe2+=Mn2++Fe3++2H2O 3.2~5.5 加水溶解,快速过滤,再加盐酸酸化至pH小于5.5 引入杂质NH4+ 锰
Mn2++Cl2↑+2H2O 滴加KSCN溶液,变红 MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O或MnOOH+3H++Fe2+=Mn2++Fe3++2H2O 3.2~5.5 加水溶解,快速过滤,再加盐酸酸化至pH小于5.5 引入杂质NH4+ 锰 ![]()
【解析】
含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)与浓盐酸反应,过滤滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+,过程II除去铁离子,过程III用锰除去铅离子。
(1)①MnO2与浓盐酸反应产生氯气,反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O ,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O ,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 。
Mn2++Cl2↑+2H2O 。
②亚铁离子与铁氰化钾溶液生成蓝色沉淀,铁离子使KSCN溶液显红色,检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无蓝色沉淀生成,另取少量滤液1于试管中,滴加KSCN溶液,变红,
故答案为:取少量滤液1于试管中,滴入铁氰化钾溶液,无蓝色沉淀生成,另取少量滤液1于试管中,滴加KSCN溶液,变红;
③Fe3+由Fe2+转化而成,由a、b两个方程式得:可能由氯气、氧气氧化,也可能由二氧化锰氧化,反应的离子方程式为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O,故答案为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;
(2)①调节pH除去铁离子,pH大于3.2时,铁离子沉淀完全,铅离子、锰离子不能沉淀,小于5.5时锰离子不易氧化,故pH应小于5.5,
故答案为:3.2~5.5;
②补全ⅱ中的操作:加水溶解,快速过滤,再加盐酸酸化至pH小于5.5 ,故答案为:加水溶解,快速过滤,再加盐酸酸化至pH小于5.5 。
③两种方法比较,氨水法除铁的缺点是:氨水法除铁的过程中,会引入杂质NH4+,
故答案为:引入杂质NH4+;
(3)过程Ⅲ的目的是除铅。用活泼金属置换不活泼金属,加入锰,将铅离子置换与溶液分离,自身生成锰离子,不引入杂质,故答案为:Mn;
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。m1gMnCl2·xH2O置于氮气氛围中加热至失去全部结晶水时,生成MnCl2质量为m2g,则n(MnCl2)=![]() ,结晶水的质量为(m1-m2)g,n(H2O)=
,结晶水的质量为(m1-m2)g,n(H2O)=![]() ,则1:x=n(MnCl2):n(H2O),解得:x=
,则1:x=n(MnCl2):n(H2O),解得:x=![]() ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 28g乙烯、丙烯的混合气体中所含原子数为6NA
B. 28g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2 L氯仿(CHCl3)所含分子数为0.5 NA
D. 78g苯中含有C—C键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种溶液,进行如下操作:则甲、乙、丙三种溶液可能是( )
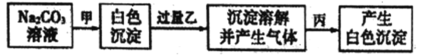
A.BaCl2、H2SO4、MgCl2B.BaCl2、HCl、Na2SO4
C.CaCl2、HNO3、NaClD.CaCl2、HNO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)向0.01 mol/L的NH4Cl溶液中分别加入少量的KOH固体、浓盐酸、FeCl3固体、Na2CO3固体,使NH4+水解平衡移动的方向分别为_____、_____、_____、____(填“右”“左”或“不移动”)
(2)写出Na2CO3溶液中的三大守恒规律
电荷守恒:_____________________;
物料守恒:_____________________;
质子守恒:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物盐酸普罗帕酮的中间体E和双酚A型聚碳酸酯H的路线:
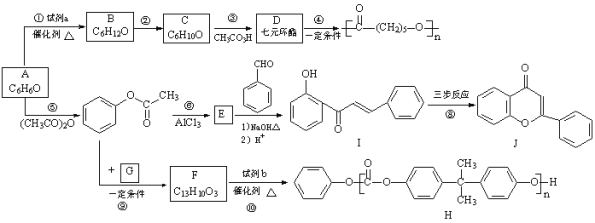
已知:i.![]()
ii.![]()
(1)A的结构简式是__________。
(2)试剂a是__________。
(3)C只含有一种官能团,反应②的化学方程式是__________。
(4)反应⑤的反应类型是__________。
(5)E中官能团是__________。
(6)下列说法正确的是:__________(填字母序号)。
a.反应③中C发生氧化反应
b.可用FeCl3溶液检验反应⑤中A是否反应完全
c.反应⑥的反应物与生成物互为同分异构体
d.反应⑩中试剂b的结构简式是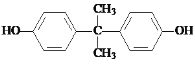
e.反应④是缩合聚合反应,生成了聚酯
(7)I→J转化的一种路线如图,已知中间产物2转化为J是消去反应,写出中间产物1和中间产物2的结构简式。
![]()
中间产物1:__________;中间产物2:__________。
(8)G的分子式为C3H6O3,只含一种官能团,且核磁共振氢谱只有一种化学环境的氢,反应⑨的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4NO3 溶液受热可发生分解反应:NH4NO3![]() N2↑+HNO3+H2O(未配平)。用 NA 表示阿伏加德罗数的值,下列说法正确的是
N2↑+HNO3+H2O(未配平)。用 NA 表示阿伏加德罗数的值,下列说法正确的是
A.分解时每生成 2.24 L(标准状况)N2,转移电子的数目为 0.6NA
B.2.8 g N2 中含有共用电子对的数目为 0.3NA
C.56 g Fe 与足量稀硝酸反应生成 NO2 分子的数目为 3NA
D.0.1 mol·L-1 NH4NO3 溶液中,NH4+的数目小于 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险.如图是氟离子电池工作示意图,其中充电时 F-从乙电极流向甲电极,下列关于该电池的说法正确的是
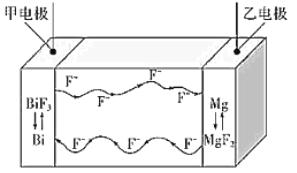
A.放电时,甲电极的电极反应式为 Bi-3e-+3F-=BiF3
B.充电时,导线上每通过1 mol e-,甲电极质量增加 19 g
C.放电时,乙电极电势比甲电极高
D.充电时,外加电源的正极与乙电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质X的产量通常用来衡量一个国家的石油化工水平。以X为主要原料合成重要的有机化合物路线如下图所示,请回答下列问题。

(1)X所含官能团的名称是______________,A物质所含官能团的名称是________。
(2)反应③的化学方程式是_______________,以乙烯为原料可合成有机高分子化合物D,反应①的化学方程式是____________________,该反应属于______反应(填有机反应类型)。
(3)下列物质中,不能通过乙烯加成反应得到的是________(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
(4)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是______。
②实验开始时,试管b中的导管不伸入液面下的原因是______。
③反应结束后,将试管b中的混合液经过____(填写实验分离操作)可得到纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向铜片中加入某浓度的硫酸120ml,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500ml。再加入足量锌粉,使之充分反应,收集到标准状况下氢气2.24L,过滤残留固体,干燥后称量,质量减轻了7.50g。求:
(1)溶解的铜的质量。______
(2)原硫酸的物质的量浓度。(要求写出简要计算过程)_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com