
����Ŀ���ϳ�ҩ������������ͪ���м���E��˫��A�;�̼����H��·�ߣ�
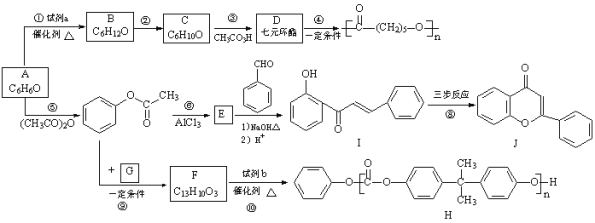
��֪��i.![]()
ii.![]()
��1��A�Ľṹ��ʽ��__________��
��2���Լ�a��__________��
��3��Cֻ����һ�ֹ����ţ���Ӧ�ڵĻ�ѧ����ʽ��__________��
��4����Ӧ�ݵķ�Ӧ������__________��
��5��E�������__________��
��6������˵����ȷ���ǣ�__________������ĸ��ţ���
a����Ӧ����C����������Ӧ
b������FeCl3��Һ���鷴Ӧ����A�Ƿ�Ӧ��ȫ
c����Ӧ�ķ�Ӧ���������ﻥΪͬ���칹��
d����Ӧ�����Լ�b�Ľṹ��ʽ��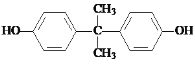
e����Ӧ�������ϾۺϷ�Ӧ�������˾���
��7��I��Jת����һ��·����ͼ����֪�м����2ת��ΪJ����ȥ��Ӧ��д���м����1���м����2�Ľṹ��ʽ��
![]()
����1��__________������2��__________��
��8��G�ķ���ʽΪC3H6O3��ֻ��һ�ֹ����ţ��Һ˴Ź�������ֻ��һ�ֻ�ѧ�������⣬��Ӧ��Ļ�ѧ����ʽ��__________��
���𰸡�![]() H2
H2 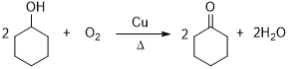 ȡ����Ӧ �ǻ����ʻ� abcd
ȡ����Ӧ �ǻ����ʻ� abcd 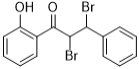
![]()
��������
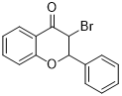
���ݢݲ���ṹ��ʽ��A����ʽ֪��AΪ![]() ����Ϊȡ����Ӧ����Ϊ�ӳɷ�Ӧ��aΪH2��BΪ
����Ϊȡ����Ӧ����Ϊ�ӳɷ�Ӧ��aΪH2��BΪ![]() ����Ϊ����������CΪ
����Ϊ����������CΪ![]() ��DӦΪ
��DӦΪ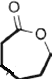 ���������Ϣ���I�Ľṹ��ʽ��֪EΪ
���������Ϣ���I�Ľṹ��ʽ��֪EΪ �������ǻ����ʻ���G�ķ���ʽΪC3H6O3��ֻ��һ�ֹ����ţ��Һ˴Ź�������ֻ��һ�ֻ�ѧ�������⣬ӦΪ
�������ǻ����ʻ���G�ķ���ʽΪC3H6O3��ֻ��һ�ֹ����ţ��Һ˴Ź�������ֻ��һ�ֻ�ѧ�������⣬ӦΪ![]() ���������Ϣ��֪FΪ
���������Ϣ��֪FΪ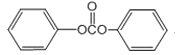 ��
��
��1��A�Ľṹ��ʽ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ;
;
��2��A�������������ӳɷ�Ӧ����B���ʴ�Ϊ��H2��
��3��Cֻ����һ�ֹ����ţ�Ϊ������![]() ����Ӧ�ڵĻ�ѧ����ʽ��:
����Ӧ�ڵĻ�ѧ����ʽ��: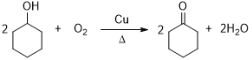 ��
��
��4����Ӧ�ݵķ�Ӧ������ȡ����Ӧ���ʴ�Ϊ��ȡ����Ӧ��
��5���ṹ��ʽ��֪EΪ �������ǻ����ʻ����ʴ�Ϊ���ǻ����ʻ���
�������ǻ����ʻ����ʴ�Ϊ���ǻ����ʻ���
��6��a��C��������ﷴӦ������Ԫ����������C����������Ӧ����a��ȷ��
b��A![]() ����FeCl3��Һ������ɫ��Ӧ������FeCl3��Һ���鷴Ӧ����A�Ƿ�Ӧ��ȫ����B��ȷ��
����FeCl3��Һ������ɫ��Ӧ������FeCl3��Һ���鷴Ӧ����A�Ƿ�Ӧ��ȫ����B��ȷ��
c��EΪ ����Ӧ�ķ�Ӧ���������ﻥΪͬ���칹�壬��c��ȷ��
����Ӧ�ķ�Ӧ���������ﻥΪͬ���칹�壬��c��ȷ��
d���Ա�F�Ľṹ��ʽ����Ӧ�����Լ�b�Ľṹ��ʽ��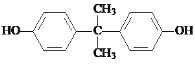 ����d��ȷ��
����d��ȷ��
e����Ӧ�������˾�����û��С�������ɣ��������ϾۺϷ�Ӧ����e����
�ʴ�Ϊ��abcd��
��7��I����̼̼˫���������巢���ӳɷ�Ӧ�����м����1�� ����ȥHBr�����м����2
����ȥHBr�����м����2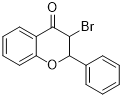 ������ȥHBr������J��
������ȥHBr������J��
�ʴ�Ϊ��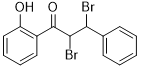 ��
�� ��
��
��8��G�ķ���ʽΪC3H6O3��ֻ��һ�ֹ����ţ��Һ˴Ź�������ֻ��һ�ֻ�ѧ�������⣬��Ӧ��Ļ�ѧ����ʽ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ס��顢����Ԫ�ؼ��仯�������ִ�ũҵ���Ƽ�����������������������ص���;��
(1)��̬��ԭ���к������ռ������ܲ�ķ���Ϊ__�����ܲ��ԭ�ӹ������__����
(2)����һ���⻯��N2H4��һ�����õĻ������ȼ�ϣ���ͳ�Ʊ��µķ����ǣ�NaClO+2NH3=N2H4+NaCl+H2O����֪�µ��۵㡢�е�ֱ�Ϊ1.4����113.5�����������۵㡢�е�ֱ�Ϊ-77.7����-33.5����
��N2H4�е�ԭ�ӵ��ӻ��������Ϊ__�ӻ�����̬Nԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ___�Ρ�
�����백���۵㡢�е��������Ҫ��ԭ����__��
(3)��������һ�ֳ������壬������[Co(NH3)6]3+�д��ڵĻ�ѧ����__(�����)��
A.���Ӽ� B.���Լ� C.��λ�� D.���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ�~����Ԫ�أ��ش��������⣺
�������� | I A | II A | III A | IV A | V A | VI A | VII A | 0�� |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
4 | �� | �� |
(1)Ԫ�آٵ�������______��Ԫ�آ������ڱ�������λ��________��
(2)Ԫ�آڵļ��⻯��ĽṹʽΪ________��
(3)�õ���ʽ��ʾԪ�آ���ߵĻ�������γɹ��̣�__________________��
(4)��ʾ����ᰴԭ�Ӹ�����1:1�γɵĻ�����ĵ���ʽ��______���û������к��еĻ�ѧ��������______��
(6)�ܡ��ޡ��ߡ�������Ԫ���γɵļ����ӣ����Ӱ뾶�ɴ�С��˳����_____(�������ӷ��ű�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ʵ����������Cu(NO3)2����Һʱ������Cu(NO3)2���������ڽ�Ũ�������У���������ˮϡ�͵������Ũ�ȣ���Ŀ����_________
��2��FeCl3��ˮ��ԭ���ǣ������ӷ���ʽ��ʾ��_________��AlCl3��Һ���ɣ����գ����õ�����Ҫ���������______��д��ѧʽ��
��3����֪�����Ƕ�Ԫ���ᣬ�����²��0.1mol/L��KHC2O4��pHΪ4.8,���KHC2O4��Һ��c(C2O42-)____c(H2C2O4) (����ڡ���С�ڡ����ڡ���
��4����ĭ�������װ��NaHCO3������Һ������Һ���ּ��Ե�ԭ���ǣ������ӷ���ʽ��ʾ��______ �����������һ������װ��Al2(SO4)3��Һ������Һ�����Ե�ԭ���ǣ������ӷ���ʽ��ʾ��_______��������ʧ��ʱ��ʹ��ĭ�����������ҡ������ʹҩҺ��ϣ���������İ�ɫ��ĭ����ֹ�������ӣ�����ص����ӷ���ʽΪ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼ�ĵ�ѭ������̬ϵͳ����ѭ������Ҫ���֣������Ӿ��˵�ѭ���е�����ת����
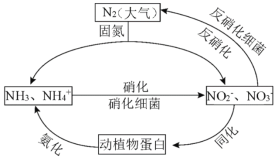
������˵����ȷ����_______������ĸ��ţ�
A.�̵������У�N2ֻ��������
B.����������Ҫ������������
C.�����������������ֲ��˹��̵��Ե�ѭ����ɵ�Ӱ��
D.ͬ�������������У�ʵ���˵�Ԫ����������л���֮���ת��
�ڷ����������У�CH3OH����Ϊ��Ӧ�Ļ�ԭ����1mol��ԭ��ʧȥ6mol���ӡ��뽫�÷�Ӧ�����ӷ���ʽ����������5CH3OH+��NO3��![]() ��_______+��_______+��_______+��_______��_____________
��_______+��_______+��_______+��_______��_____________
��2���о��������������NOx���Ͷ���������������������γ��йء�
����֪��SO2����SO3�ܷ�Ӧ����ʽ��2SO2(g)��O2(g)![]() 2SO3(g)��H����196.6kJ/mol
2SO3(g)��H����196.6kJ/mol
�˷�Ӧ��ͨ������������ɣ�2NO(g)��O2(g)![]() 2NO2(g)��H1����113kJ/mol
2NO2(g)��H1����113kJ/mol
NO2(g)��SO2(g)![]() SO3(g)��NO(g)��H2��_______��
SO3(g)��NO(g)��H2��_______��
��һ���¶��£���2L�����ܱ������г���NO2��SO2��1mol��5min�ﵽƽ�⣬��ʱ������NO2��NO��Ũ��֮��Ϊ1��3����NO2��ƽ��ת������_______��
��3���飨As���ǵ������ڢ�A��Ԫ�أ��仯������Ź㷺����;��
��AsH3���ȶ��Ա�NH3���ȶ���_______������ǿ��������������������ԭ�ӽṹ����ԭ��_______��
�ڳ��������������Ҫ�ɷ�ΪAs2S3���Ƴɽ�״��ͨ��O2����������H3AsO4�͵�����д��������Ӧ�Ļ�ѧ����ʽ_______��
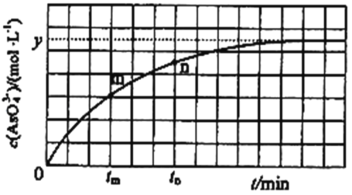
��298Kʱ����20mL3xmolL-1Na3AsO3��20mL3xmolL-1I2��20mLNaOH��Һ��ϣ�������Ӧ��AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l)����Һ��c(AsO43��)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ����ƽ��ʱ��Һ��pH=14����÷�Ӧ��ƽ�ⳣ��KΪ_______��
AsO43-(aq)+2I-(aq)+H2O(l)����Һ��c(AsO43��)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ����ƽ��ʱ��Һ��pH=14����÷�Ӧ��ƽ�ⳣ��KΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ԷϾ�п�̵�س���������ѡ���ĺ��̷��ϣ�MnO2��MnOOH��MnO������Fe��Pb�ȣ�Ϊԭ���Ʊ��ߴ�MnCl2��xH2O��ʵ���̵��������á��乤�����̣�
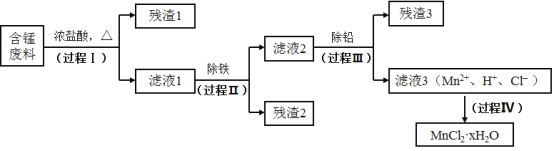
����a��Mn�Ľ������ǿ��Fe��Mn2+�����������±Ƚ��ȶ���pH����5.5ʱ�ױ�O2������
����b�������������������pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
��ʼ����ʱ | 8.1 | 6.5 | 1.9 |
��ȫ����ʱ | 10.1 | 8.5 | 3.2 |
ע���������ӵ���ʼŨ��Ϊ0.1mol��L-1
��1�����̢��Ŀ���ǽ����̡���������Һ1�к��е�������ΪMn2+��Fe3+��Pb2+��H+��
��MnO2��Ũ���ᷴӦ�����ӷ���ʽ��_____________��
�ڼ�����Һ1��ֻ��Fe3+����Fe2+�IJ����������ǣ�ȡ������Һ1���Թ��У��������軯����Һ������ɫ�������ɣ���ȡ������Һ1���Թ��У�_____________��
��Fe3+��Fe2+ת�����ɣ����ܷ����ķ�Ӧ�У�
a��2Fe2++Cl2=2Fe3++2Cl��
b��4Fe2++O2+4H+=2Fe3++2H2O
c��......
д��c�����ӷ���ʽ��_____________��
��2�����̢��Ŀ���dz��������������ַ�����
��.��ˮ��������Һ1��ϡ�ͣ��ټ�����10%�İ�ˮ�����ˡ�
��.���շ�������Һ1Ũ���õ��Ĺ�����290�決�գ���ȴ��ȡ������......��
��֪�������з�������Ҫ��ӦΪ2FeCl3+3O2=2Fe2O3+3Cl2��MnCl2��PbCl2�������仯��
�ٰ�ˮ������ʱ����ҺpHӦ������_____________֮�䡣
�ڲ�ȫ���еIJ�����_____________��
�����ַ����Ƚϣ���ˮ��������ȱ����_____________��
��3�����̢��Ŀ���dz�Ǧ��������Լ���_____________��
��4�����̢����ù����е�x�IJⶨ���£�ȡm1g��Ʒ�����ڵ�����Χ�м�����ʧȥȫ���ᾧˮʱ��������Ϊm2g����x=_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1-�ȱ����2-�ȱ���ֱ���NaOH�Ҵ���Һ���ȵķ�Ӧ�������й�˵������ȷ���ǣ� ��
A. ������ͬB. ̼������ѵ�λ����ͬ
C. ��Ӧ������ͬD. 1-�ȱ����2-�ȱ��鶼����NaOHˮ��Һ���ȵķ�����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ʵ������Ũ������Ҵ���һ���¶����Ʊ���ϩ��ijѧϰС�����ʵ����������װ��֤��Ũ�����ڸ÷�Ӧ�еĻ�ԭ������SO2�����Ʊ�1��2-�������顣
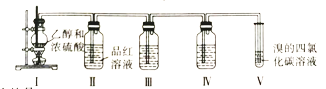
����˵����ȷ����
A.Ũ�����ڸ÷�Ӧ����Ҫ�����Ǵ�������ˮ��
B.װ��III��IV�е��Լ�����Ϊ���Ը��������Һ��Ʒ����Һ
C.ʵ����Ϻ�����ȡ��Һ��������1��2-��������
D.װ��II��Ʒ����Һ��ɫ������SO2�Ļ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ȼ�ϵ�أ���ͼ��ʾ������˵������ȷ����
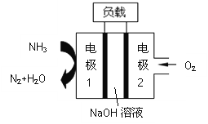
A.�����ĵ缫��ӦʽΪO2+4e��+4H+=2H2O
B.�������缫1���������缫2
C.Na+���������ƶ�
D.NH3�ڵ缫1�Ϸ���������Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com