
【题目】氮、磷、砷、铁等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)基态砷原子中核外电子占据最高能层的符号为__,该能层的原子轨道数有__个。
(2)氮的一种氢化物N2H4是一种良好的火箭发射燃料,传统制备肼的方法是:NaClO+2NH3=N2H4+NaCl+H2O,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
①N2H4中氮原子的杂化轨道类型为__杂化,基态N原子电子占据最高能级的电子云轮廓图为___形。
②肼与氨气熔点、沸点差异最主要的原因是__。
(3)氨分子是一种常见配体,配离子[Co(NH3)6]3+中存在的化学键有__(填序号)。
A.离子键 B.极性键 C.配位键 D.氢键
【答案】N 16 sp3 哑铃型 N2H4分子间氢键数目多于NH3分子间氢键数目 BC
【解析】
砷位于周期表中第4周期第ⅤA族;根据核外电子的排布式判断最高能层和该能层具有的轨道数;根据价层电子对互斥理论判断N2H4的杂化类型;分子间含有氢键多的沸点较高;配离子[Co(NH3)6]3+中存在的化学键有配位键,配体NH3中含有极性共价键,然后分析。
(1)砷位于周期表中第4周期第ⅤA族,基态As核外电子占据最高能层为N,N能层具有s、p、d、f四个能级,s上有1个轨道,p上有3个轨道,d上有5个原子轨道,f上有7个原子轨道,所以共有16个原子轨道;
(2) ①肼的电子式为: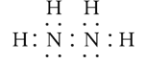 ,N2H4中N原子含有3对成键电子对和1对孤电子对,则价层电子对数为4,所以氮原子杂化轨道类型为sp3杂化,基态N原子的核外电子排布式为:1s22s22p3,电子占据最高能级为2p能级,电子云轮廓图为哑铃型;
,N2H4中N原子含有3对成键电子对和1对孤电子对,则价层电子对数为4,所以氮原子杂化轨道类型为sp3杂化,基态N原子的核外电子排布式为:1s22s22p3,电子占据最高能级为2p能级,电子云轮廓图为哑铃型;
②N2H4分子间氢键数目多于NH3分子间氢键数目,导致肼与氨气熔点、沸点差异较大;
(3)配离子[Co(NH3)6]3+中存在氨分子和钴离子之间的配位键,配体NH3中存在极性共价键,配离子[Co(NH3)6]3+中存在的化学键有极性键和配位键,答案选BC。


科目:高中化学 来源: 题型:
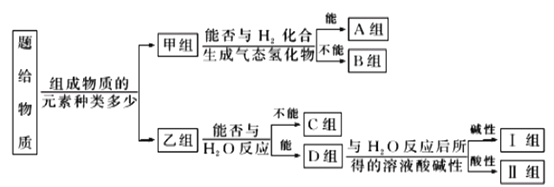
【题目】现有NH3、CO、Na、Na2O2、Fe、NO、NO2、F2、SO2、SOCl2等物质,根据它们的组成及性质进行如下分类:
请回答下列问题:
(1)图中所示的分类方法叫___________。
(2)淡黄色固体最终位于__________组,它的电子式为___________。
(3)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有8×6.02×1023个电子转移,则有__g该物质参与反应。
(4)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式___________。
(5)II组某种物质能与水发生氧化还原反应,该反应中被氧化元素与被还原的元素的质量比为___________。
(6)II组另有一种物质滴入水中后与水剧烈反应,元素化合价不发生变化,该物质与水反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物结构如图,下列说法中正确的是![]()

A. 该物质的化学式为C15H8O8BrCl
B. 该物质能与![]() 溶液发生显色反应
溶液发生显色反应
C. 1mol该物质最多能与3mol溴水发生加成反应
D. 一定条件下,1mol该物质最多能与8molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸盐与钴(Ⅲ)形成的一种配合物[Co(NH3)5NO2]Cl2的制备流程如下:
CoCl2·6H2O![]() [Co(NH3)5Cl]Cl2
[Co(NH3)5Cl]Cl2![]() [Co(NH3)5NO2]Cl2
[Co(NH3)5NO2]Cl2
(1)Co2+基态核外电子排布式为___。
(2)配合物[Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为___(填元素符号);配离子[Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为___。
(3)NO![]() 的空间构型为___,与它互为等电子体的分子为___(写化学式)。
的空间构型为___,与它互为等电子体的分子为___(写化学式)。
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为___。
(5)1mol[Co(NH3)5Cl]Cl2中含有σ键的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 28g乙烯、丙烯的混合气体中所含原子数为6NA
B. 28g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2 L氯仿(CHCl3)所含分子数为0.5 NA
D. 78g苯中含有C—C键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
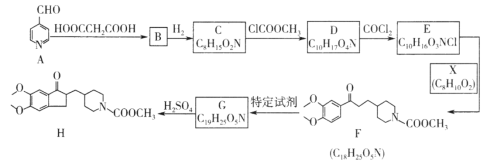
【题目】可用于治疗阿尔茨海默病的某种药物中间体H的合成路线如图所示:
已知:i.![]()
ii.
(1)A中含氧官能团的名称是___________;B→C的反应类型是______________。
(2)G的结构简式是___________________。
(3)E→F的化学方程式是______________________。
(4)芳香化合物Y是X的同分异构体,1molY可与2molNaOH反应,Y共有__________种(不含立体结构),其中核磁共振氢谱为4组峰,峰面积比为1:6:2:1的结构简式是______________________。
(5)设计由乙醇和HOOCCH2COOH制备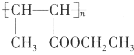 的合成路线(无机试剂任选)。__________
的合成路线(无机试剂任选)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
Ⅰ.已知H—H键的键能为a kJ·mol-1,N—H键的键能为bkJ·mol-1,N![]() N键的键能是ckJ·mol-1,则反应NH3(g)
N键的键能是ckJ·mol-1,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的ΔH=____kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)
H2(g)的ΔH=____kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)![]() 2NH3(g)的平衡常数K1=____(用K表示)。
2NH3(g)的平衡常数K1=____(用K表示)。
Ⅱ.一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的饮用水二级消毒剂。
(1)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃___400℃(填“>”或“<”),该反应的ΔH___0(填“>”或“<”)。
②该反应自发行的条件是____(填高温、低温、任何温度)。
③对该反应,下列说法正确的是___(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达平衡后,其他条件不变,加入一定量的NCl3,平衡将向逆反应方向移动
D.反应达到平衡后,其他条件不变,在原容器中按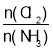 =1继续充入一定量反应物,达新平衡后Cl2的转化率增大
=1继续充入一定量反应物,达新平衡后Cl2的转化率增大
(2)工业上可利用反应2Cl2(g)+NH3(g)![]() NHCl2 (l)+2HCl(g)制备二氯胺。
NHCl2 (l)+2HCl(g)制备二氯胺。
①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出该反应的化学方程式____。
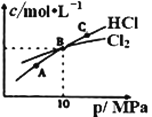
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是___点(填“A”“B”或“C”);B点时反应物转化率:α(Cl2)___α(NH3)(填“>”“=”或“<”),若B点平衡体积为2L,则平衡常数K=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物盐酸普罗帕酮的中间体E和双酚A型聚碳酸酯H的路线:
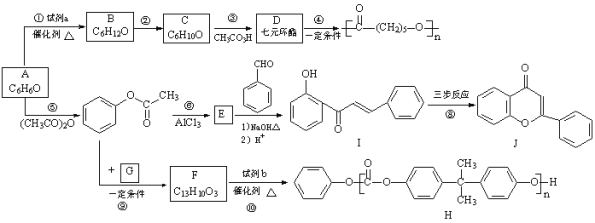
已知:i.![]()
ii.![]()
(1)A的结构简式是__________。
(2)试剂a是__________。
(3)C只含有一种官能团,反应②的化学方程式是__________。
(4)反应⑤的反应类型是__________。
(5)E中官能团是__________。
(6)下列说法正确的是:__________(填字母序号)。
a.反应③中C发生氧化反应
b.可用FeCl3溶液检验反应⑤中A是否反应完全
c.反应⑥的反应物与生成物互为同分异构体
d.反应⑩中试剂b的结构简式是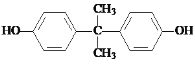
e.反应④是缩合聚合反应,生成了聚酯
(7)I→J转化的一种路线如图,已知中间产物2转化为J是消去反应,写出中间产物1和中间产物2的结构简式。
![]()
中间产物1:__________;中间产物2:__________。
(8)G的分子式为C3H6O3,只含一种官能团,且核磁共振氢谱只有一种化学环境的氢,反应⑨的化学方程式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com