
【题目】现有NH3、CO、Na、Na2O2、Fe、NO、NO2、F2、SO2、SOCl2等物质,根据它们的组成及性质进行如下分类:
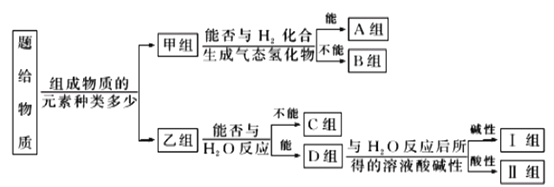
请回答下列问题:
(1)图中所示的分类方法叫___________。
(2)淡黄色固体最终位于__________组,它的电子式为___________。
(3)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有8×6.02×1023个电子转移,则有__g该物质参与反应。
(4)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式___________。
(5)II组某种物质能与水发生氧化还原反应,该反应中被氧化元素与被还原的元素的质量比为___________。
(6)II组另有一种物质滴入水中后与水剧烈反应,元素化合价不发生变化,该物质与水反应的化学方程式___________。
【答案】树状分类法 I组  168 3CO+Fe2O3
168 3CO+Fe2O3![]() 3CO2+2Fe 2:1 SOCl2+H2O =SO2+2HCl
3CO2+2Fe 2:1 SOCl2+H2O =SO2+2HCl
【解析】
按照不同的标准,给物质分类。
(1)由分类的角度可知为树状分类法;
(2)淡黄色固体为Na2O2,可与水反应生成NaOH和氧气;过氧化钠为离子化合物,据此书写电子式;
(3)B组中与水在高温条件下反应的物质为Fe,根据反应方程式分析;
(4)依据高炉炼铁原理,一氧化碳与氧化铁反应生成铁和二氧化碳解答;
(5)Ⅱ组的某种物质能与水发生氧化还原反应生成酸,该物质为NO2,据此书写离子方程式;
(6)根据化合价不变,推测出产物,再根据原子守恒写出方程式。
物质按照组成物质的元素种类分类,Na、Fe、F2为一组,只由一种元素组成,能够和H2化合的为F2,则A组中有F2,B组中Na和Fe;乙组中均为化合物,能够与水反应的有CO、NO,则C组中有CO和NO。能够与水反应的中,生成碱的有NH3和Na2O2;则Ⅰ组中有NH3和Na2O2。Ⅱ组中有NO2、SO2、SOCl2。
(1)图示方法将多种单质和化合物按照层次,一层一层来分,符合树状分类的特点,属于树状分类;
(2)淡黄色固体为Na2O2,可与水反应生成NaOH和氧气,最终位于I组;Na2O2是钠离子和过氧根离子构成的离子化合物,电子式为 ;
;
(3)B组中Fe可以在高温下与水蒸气发生反应;化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;若该反应过程中有8×6.02×1023个电子转移,即转移8mol电子,则消耗3molFe,即3mol×56g·mol-1=168g;
Fe3O4+4H2;若该反应过程中有8×6.02×1023个电子转移,即转移8mol电子,则消耗3molFe,即3mol×56g·mol-1=168g;
(4)C组有一种气体常用作工业上冶炼铁的还原剂是CO,CO与Fe2O3的反应方程式为3CO+Fe2O3 ![]() 3CO2+2Fe;
3CO2+2Fe;
(5)Ⅱ组的某种物质能与水发生氧化还原反应,该物质为NO2,二氧化氮与水反应生成硝酸和一氧化氮,化学方程式为3NO2+H2O=2HNO3+NO;3molNO2中化合价升高的N有2mol,化合价降低的N有1mol;则被氧化的NO2有2mol,被还原的NO2有1mol,比例为2:1;
(6)Ⅱ组另有一种物质滴入水中后与水激烈反应,该物质为SOCl2,其化合价不变,S的化合价为+4,则生成SO2,Cl的化合价为-1,生成HCl。化学方程式为SOCl2+H2O =SO2+2HCl。


科目:高中化学 来源: 题型:
【题目】对于4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应来说,以下化学反应速率的表示中反应速率最快的是( )
A.v(NH3)=0.6mol·L-1·s-1B.v(O2)=0.4mol·L-1·s-1
C.v(N2)=0.2mol·L-1·s-1D.v(H2O)=1.2mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是一些常见物质间互相转化的关系图(部分反应条件已省略)。已知A、B、X、Y均为无色气体,E、F为常见单质。
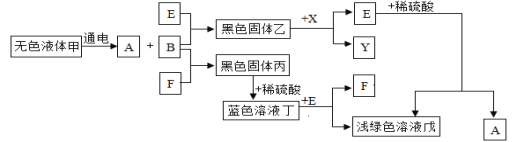
请回答:
(1)写出下列物质的化学式:F__、戊__。
(2)写出下列转化的化学方程式:
①甲→A+B___;
②乙+X→E+Y___。
(3)说出蓝色溶液丁中溶质的一种用途___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
A. 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA
B. 2.3g钠在空气中燃烧生成多种氧化物是转移电子数为0.1NA
C. 1.8g D2O中含有的质子数为1.0NA
D. 235g核素![]() 发生裂变反应
发生裂变反应![]() +
+ ![]()
![]()
![]() Sr+
Sr+![]() Xe+10
Xe+10![]() n,净产生的中子(
n,净产生的中子(![]() n)数为10NA
n)数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.2%的盐酸(密度为1.16gcm-3)配置1.0molL-1的稀盐酸。现实验室需要这种稀盐酸220mL,试回答下列问题:
(1)配置稀盐酸时,应选用容积为___________mL的容量瓶。
(2)经计算需要___________mL浓盐酸,在量取时宜选用下列量筒中的___________。
A.2mL B.10mL C.22mL D.20mL
(3)在量取浓盐酸后,进行了下列操作:
①待稀释的盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线12cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的是顺序是(填序号)___________。
(4)在上述配制过程中,用刚刚洗涤洁净还有少量筒来量取浓盐酸,其配制的稀盐酸浓度_______(填“偏高”“偏低”或“无影响”,下同)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶则配制的稀盐酸浓度___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)①H3PO2是一元中强酸,写出其电离方程式______________________。
②NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显___________(填“弱酸性”“中性”或“弱碱性”)。
③H3PO2中,P元素的化合价为___________;
(2)H3PO2可用于化学镀银,反应中Ag+还原为银,H3PO2氧化为H3PO4,该反应中氧化剂与还原剂的物质的量之比为________。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4 反应,写出白磷与Ba(OH)2溶液反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
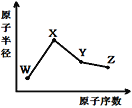
A. 化合物XZW既含离子键也含共价键
B. 对应气态氢化物的稳定性Y>Z
C. X和W两种元素形成的化合物是共价化合物
D. Y的氧化物能与Z或X的最高价氧化物对应的水化物都能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(2019-nCOV)的感染,其结构如图所示。下列说法错误的是
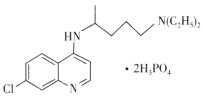
A.基态C1原子的核外电子有17种运动状态
B.C、N、O、P四种元素中电负性最大的是O
C.H3PO4分子中磷原子的价层电子对数为4
D.与足量H2发生加成反应后,该分子中手性碳原子个数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷、铁等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)基态砷原子中核外电子占据最高能层的符号为__,该能层的原子轨道数有__个。
(2)氮的一种氢化物N2H4是一种良好的火箭发射燃料,传统制备肼的方法是:NaClO+2NH3=N2H4+NaCl+H2O,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
①N2H4中氮原子的杂化轨道类型为__杂化,基态N原子电子占据最高能级的电子云轮廓图为___形。
②肼与氨气熔点、沸点差异最主要的原因是__。
(3)氨分子是一种常见配体,配离子[Co(NH3)6]3+中存在的化学键有__(填序号)。
A.离子键 B.极性键 C.配位键 D.氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com