
����Ŀ������������Ϊ36.2%�����ᣨ�ܶ�Ϊ1.16gcm-3������1.0molL-1��ϡ���ᡣ��ʵ������Ҫ����ϡ����220mL���Իش��������⣺
��1������ϡ����ʱ��Ӧѡ���ݻ�Ϊ___________mL������ƿ��
��2����������Ҫ___________mLŨ���ᣬ����ȡʱ��ѡ��������Ͳ�е�___________��
A.2mL B.10mL C.22mL D.20mL
��3������ȡŨ������������в�����
�ٴ�ϡ�͵�������¶�������һ�º��ز�����ע������ƿ�С�
��������ƿ��С�ļ�����ˮ��Һ��������ƿ�̶���12cmʱ�����ý�ͷ�ιܼ�����ˮ��ʹ��Һ��Һ����ƿ���Ŀ̶������С�
����ʢ������ձ���ע������ˮ�����ò�����������ʹ���Ͼ��ȡ�
��������ˮϴ���ձ��Ͳ�����2��3�Σ�����ϴ��Һȫ��ע������ƿ��
���������У���ȷ����˳���ǣ�����ţ�___________��
��4�����������ƹ����У��øո�ϴ�ӽྻ��������Ͳ����ȡŨ���ᣬ�����Ƶ�ϡ����Ũ��_______���ƫ�ߡ���ƫ�͡�����Ӱ�족����ͬ������δ������ˮϴ���ձ��ڱڻ�δ��ϴ��Һע������ƿ�����Ƶ�ϡ����Ũ��___________��
���𰸡�250mL 21.7 C �ۢ٢ܢ� ƫ�� ƫ��
��������
(1)����������Һ�����ѡȡ��Ӧ������ƿ��
(2)�ȼ����Ũ��������ʵ���Ũ��![]() ��Ȼ�������Һϡ��ǰ�����ʵ��������������Ũ����������������Һϡ��ǰ�����ʵ��������������Ũ����������ѡ����ʵ���Ͳ��
��Ȼ�������Һϡ��ǰ�����ʵ��������������Ũ����������������Һϡ��ǰ�����ʵ��������������Ũ����������ѡ����ʵ���Ͳ��
(3)����ʵ������IJ��裬����
(4)����![]() �������������ʵ����ʵ��������Һ�������Ӱ���жϡ�
�������������ʵ����ʵ��������Һ�������Ӱ���жϡ�
(1)��������Һ�����Ϊ220mL������ƿ�Ĺ����û��220mL������ֻ��ѡ250mL��
(2)Ũ��������ʵ���Ũ��Ϊ![]() ��������Ũ��������ΪV������V��11.5mol��L��1=0.25L��1mol��L��1����V��21.7mL��Ӧ��ѡȡ����Ͳ�Ĺ�����ȡ�����Ҫ���ҿ�����ӦѡC��
��������Ũ��������ΪV������V��11.5mol��L��1=0.25L��1mol��L��1����V��21.7mL��Ӧ��ѡȡ����Ͳ�Ĺ�����ȡ�����Ҫ���ҿ�����ӦѡC��
(3)������������ȡ��ϡ�͡���Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�������˳�ۢ٢ܢڣ�
(4)���øո�ϴ�ӽྻ����Ͳ����ȡŨ���ᣬŨ����Ũ�ȼ��٣�����ȡ��Һ�����ʵ��������٣�Ũ��ƫ�ͣ��ʴ�Ϊ��ƫ�ͣ���δ������ˮϴ���ձ��ڱڻ�δ��ϴ��Һע������ƿ�����ʵ��������٣�Ũ��ƫ�ͣ��ʴ�Ϊ��ƫ�͡�


 ����ʦ���һ��һ��ϵ�д�
����ʦ���һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ס��ҡ����������ʾ�����ͬ��Ԫ��X����ת����ϵ���£�
![]()
����˵���������
A.��AΪNaOH��Һ����Ϊ��ɫ��������X����Ϊ�����ڽ���Ԫ��
B.��AΪ���ᣬXΪ����Ԫ�أ�������ҷ�Ӧ�����ɱ�
C.��AΪ����������ͨ��״����Ϊ����ɫ���壬�����Ϊ�ǽ�������
D.����ΪNaHCO3������������CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ�Ǻϳ��������������в��ϩ�����������ͭ����Ҫǰ����֮һ��
��ͼ1������һ��ʵ���Һϳ�·�ߣ�
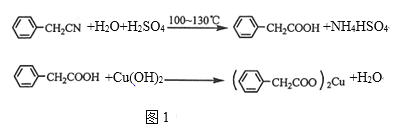
�Ʊ��������װ����ͼ2��ʾ�����Ⱥͼг�װ�õ��ԣ���
��֪����������۵�76.5�棬������ˮ��������ˮ���Ҵ���
�ش���������
��1����250mL����ƿa�м���70mL70%���ᣬ��a�е���Һ������100�棬�����μ�40g�����浽������Һ�У�Ȼ��������130�������Ӧ��
����װ���У�����b��������_______��
������c��������_________����������_______��
�۷�Ӧ��������������ˮ��ϣ���ϵIJ�����_______������ˮ��ϵ�Ŀ����______��
��2�����������п����ڷ��뱽�����Ʒ����__________������ĸ����
A ��Һ©�� B ©�� C �ձ� D ֱ�������� E ������
��3���ᴿ������ķ����ǣ���������ֲ�Ʒ���뵽______�����ܽ⣬Ȼ��_____�����____�����յõ�44g��Ʒ��������IJ�����_______��
��4������������뵽�Ҵ���ˮ�Ļ���ܼ��У�����ܽ����Cu��OH��2����30min�����ˣ���Һ����һ��ʱ�䣬����������ͭ���壬����ܼ����Ҵ���������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2-����-1,3-�������ɼ䱽�����Ȼǻ�������������ȥ��������ɡ�ԭ�����£�
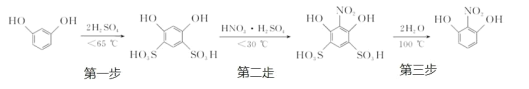
�������ʵ�����������£�
���� | ��״ | �۵�/�� | ˮ���ԣ����£� |
�䱽���� | ��ɫ��״���� | 110.7 | ���� |
2-����-1,3-������ | �ۺ�ɫ��״���� | 87.8 | ���� |
�Ʊ��������£�
��һ�����ǻ�����ȡһ�������ļ䱽���ӣ���ɷ�ĩ������ƿ�У�������������Ũ���Ტ���Ͻ��裬�����¶���һ����Χ�ڷ�Ӧ 15 min����ͼ 1����
�ڶ��������������ǻ���Ӧ��������ƿ������ˮ�У������ȴ����롰���ᡱ�������¶ȼ�����15 min��������������������Ӧ������ϡ��Һת�Ƶ�Բ����ƿ B �У�Ȼ����ͼ 2 ��ʾװ�ý���ˮ���������ռ������õ� 2-����-1,3-�����Ӵ�Ʒ��
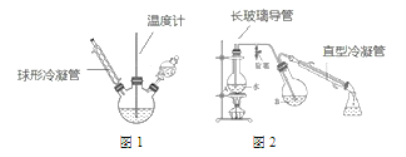
��ش��������⣺
��1���ǻ������п����¶�����ʵķ�ΧΪ������ĸ��________��
a.30 �桫60 �� b.60 �桫65 �� c.65 �桫70 �� d.70 �桫100 ��
��2�����ǻ��ڶ�λ����ԭ�ӱȽϻ��ã����ױ�ȡ�����������һ���ǻ������������ţ�-SO3H����������_______________________��
��3��������������ȡ�����ᡱ�ľ��������______________________��
��4������˵����ȷ����_______________��
a ֱ���������ڱ��п��ܻ��к�ɫ��������
b ͼ 2 �е�����������ͼ 1 �е������ܴ���
c ��ƿA�г�����������ѹ���ã����ܷ�ֹװ����ѹǿ���������¹ʣ����ܷ�ֹѹǿ��С��������
��5���������У�ˮ���������������__________________����ͨ��________�����������һ���ᴿ 2-����-1,3-�����ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ2HI(g) ![]() H2(g) +I2(g),���������ܹ�˵������ƽ��״̬����
H2(g) +I2(g),���������ܹ�˵������ƽ��״̬����
A. ����������ɫ���ٱ仯
B. �¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯
C. lmolH-H�����ɵ�ͬʱ��2molH-I������
D. �����ʵ����ʵ���Ũ��֮��Ϊ2��1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NH3��CO��Na��Na2O2��Fe��NO��NO2��F2��SO2��SOCl2�����ʣ��������ǵ���ɼ����ʽ������·��ࣺ
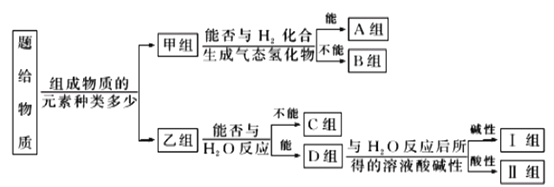
��ش��������⣺
��1��ͼ����ʾ�ķ������___________��
��2������ɫ��������λ��__________�飬���ĵ���ʽΪ___________��
��3��B������һ�������ڸ���������ˮ������Ӧ�����÷�Ӧ��������8��6.02��1023������ת�ƣ�����__g�����ʲ��뷴Ӧ��
��4��C����һ�����峣������ҵ��ұ�����Ļ�ԭ����д������������ԭFe2O3�Ļ�ѧ����ʽ___________��
��5��II��ij����������ˮ����������ԭ��Ӧ���÷�Ӧ�б�����Ԫ���뱻��ԭ��Ԫ�ص�������Ϊ___________��
��6��II������һ�����ʵ���ˮ�к���ˮ���ҷ�Ӧ��Ԫ�ػ��ϼ۲������仯����������ˮ��Ӧ�Ļ�ѧ����ʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�������һ��̫����������H2S�ֽ�װ�ã�����ԭ����ͼ��ʾ�����������������
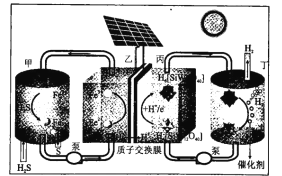
A.���������ĵ缫��ӦΪ![]()
B.����![]() �ڴ������淢���绯ѧ��Ӧ����
�ڴ������淢���绯ѧ��Ӧ����![]() ��H2
��H2
C.�����ϼ���ÿ����1molSʱͨ�����ӽ���Ĥ��H+Ϊ2mol
D.��װ��ʵ��������̫���ܼ�ӽ�H2S�ֽ�ΪS��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������������ȷ����
A.��״���£�11.2LCHC13�к��е���ԭ����ĿΪ1.5NA
B.10.0g��������Ϊ46�����Ҵ���Һ�������Ʒ�Ӧ������H2��ĿΪ0.05NA
C.���³�ѹ�£�124gP4�к�������ĿΪ4NA
D.��1L1mol��L��1NH4Cl��Һ�м��백ˮ�����ԣ���Һ��![]() ��ĿΪNA
��ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������(��)�γɵ�һ�������[Co(NH3)5NO2]Cl2���Ʊ��������£�
CoCl2��6H2O![]() [Co(NH3)5Cl]Cl2
[Co(NH3)5Cl]Cl2![]() [Co(NH3)5NO2]Cl2
[Co(NH3)5NO2]Cl2
(1)Co2+��̬��������Ų�ʽΪ___��
(2)�����[Co(NH3)5Cl]Cl2����Co3+�γ���λ����ԭ��Ϊ___(��Ԫ�ط���)��������[Co(NH3)5NO2]2+�������е�ԭ�ӵ��ӻ��������Ϊ___��
(3)NO![]() �Ŀռ乹��Ϊ___��������Ϊ�ȵ�����ķ���Ϊ___(д��ѧʽ)��
�Ŀռ乹��Ϊ___��������Ϊ�ȵ�����ķ���Ϊ___(д��ѧʽ)��
(4)H2O2��H2O��������������ܣ�����Ϊ���Ƕ��Ǽ��Է����⣬����Ϊ___��
(5)1mol[Co(NH3)5Cl]Cl2�к�����������ĿΪ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com