
【题目】用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
A. 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA
B. 2.3g钠在空气中燃烧生成多种氧化物是转移电子数为0.1NA
C. 1.8g D2O中含有的质子数为1.0NA
D. 235g核素![]() 发生裂变反应
发生裂变反应![]() +
+ ![]()
![]()
![]() Sr+
Sr+![]() Xe+10
Xe+10![]() n,净产生的中子(
n,净产生的中子(![]() n)数为10NA
n)数为10NA
【答案】B
【解析】
A.常温常压下,不能用L·mol-1来计算氯气的物质的量,22.4L氯气不是1mol,转移的电子数也不是2NA,A项错误;
B.2.3gNa的物质的量为0.1mol,反应中Na元素的化合价由0价升高为+1价,不管产物是过氧化钠还是氧化钠,还是多种氧化物的混合物,都失去1个电子得到Na+,转移电子数0.1NA;B项正确;
C.1.8g D2O的物质的量为:1.8g/20g·mol-1=0.09mol,含有质子的物质的量为:0.09mol×10=0.9mol,含有的质子数为0.9NA,C项错误;
D.1个中子轰击U核,得到了10个中子,净产生的中子为9个 235g核素![]() 其物质的量为1mol,净产生的中子为9 NA,D项错误;
其物质的量为1mol,净产生的中子为9 NA,D项错误;
本题答案选B。


科目:高中化学 来源: 题型:
【题目】利用钛矿的酸性废液(含TiO2+、Fe2+、Fe3+、SO42-等),可回收获得FeS2纳米材料、Fe2O3和TiO2·nH2O等产品,流程如下:
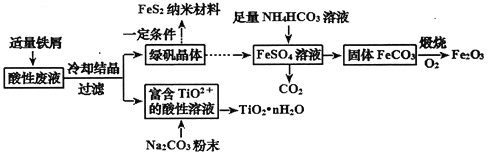
(1)TiO2+中钛元素的化合价为________价。TiO2+只能存在于强酸性溶液中,因为TiO2+易水解生成TiO2·nH2O,写出水解的离子方程式_________________________________。
(2)向富含TiO2+的酸性溶液中加入Na2CO3粉末能得到固体TiO2·nH2O。请用化学反应原理解释__________________________________。
(3)NH4HCO3溶液与FeSO4溶液反应的离子方程式为_______________________,该反应需控制温度在308K以下,其目的是_____________________________。
(4)已知298K时,Ksp[Fe(OH)2]=8.0×10-16,若在生成的FeCO3达到沉淀溶解平衡时,测得溶液的pH为8.5,c(Fe2+)=1.0×10-5mol·L-1,则所得的FeCO3中________Fe(OH)2(填“有”或“没有”)。
(5)FeS2纳米材料可用于制造高容量锂电池,已知电解质为熔融的K2S,电池放电时的总反应为:4Li+FeS2=Fe+2Li2S,则正极的电极反应式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位,请据图回答下列问题:
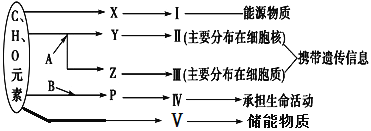
(1)图中A代表的元素是(用元素符号填写)_______________。图中X是_______________,Ⅰ在小麦种子中主要是指_______________。
(2)Ⅴ在动物、植物细胞均含有,是生物体内理想的储能物质,则Ⅴ是_______________。
(3)物质P是_______________,其结构通式为______________________________;若Ⅳ分子由n个P分子(平均相对分子质量为m)组成的2条链组成,则该Ⅳ分子的相对分子质量大约为______________。从理论上分析,该Ⅳ物质至少有_____个氨基和_____个羧基。
(4)生物体中的Ⅱ、Ⅲ的基本组成单位是__________各单位间是通过______________键连接起来的,可以通过___________________________对细胞进行染色,染色后Ⅱ呈现出_______色,Ⅲ呈现出_______色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“Na—CO2”电池可将 CO2 变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电时总反应的化学方程式为 4Na+3CO2=2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中不正确的是
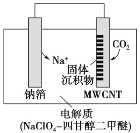
A.电流流向为 MWCNT→导线→钠箔
B.放电时,正极的电极反应式为 3CO2+4Na++4e-=2Na2 CO3+C
C.选用高氯酸钠—四甘醇二甲醚作电解液的优点是导电性好,不与金属钠反应,难挥发
D.原两电极质量相等,若生成的Na2CO3 和C 全部沉积在电极表面,当转移 0.2 mol e-时,两极的质量差为 11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
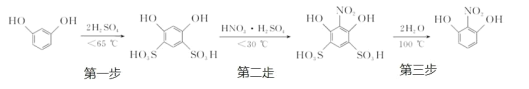
【题目】2-硝基-1,3-苯二酚由间苯二酚先磺化,再硝化,后去磺酸基生成。原理如下:
部分物质的相关性质如下:
名称 | 性状 | 熔点/℃ | 水溶性(常温) |
间苯二酚 | 白色针状晶体 | 110.7 | 易溶 |
2-硝基-1,3-苯二酚 | 桔红色针状晶体 | 87.8 | 难溶 |
制备过程如下:
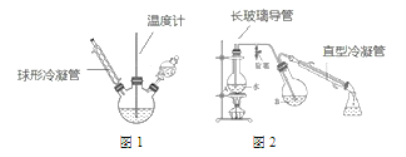
第一步:磺化。称取一定质量的间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内反应 15 min(如图 1)。
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅15 min。第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶 B 中,然后用图 2 所示装置进行水蒸气蒸馏,收集馏出物,得到 2-硝基-1,3-苯二酚粗品。
请回答下列问题:
(1)磺化步骤中控制温度最合适的范围为(填字母)________。
a.30 ℃~60 ℃ b.60 ℃~65 ℃ c.65 ℃~70 ℃ d.70 ℃~100 ℃
(2)酚羟基邻对位的氢原子比较活泼,均易被取代,请分析第一步磺化引入磺酸基基团(-SO3H)的作用是_______________________。
(3)硝化步骤中制取“混酸”的具体操作是______________________。
(4)下列说法正确的是_______________。
a 直型冷凝管内壁中可能会有红色晶体析出
b 图 2 中的冷凝管能用图 1 中的冷凝管代替
c 烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止压强过小引起倒吸。
(5)蒸馏步骤中,水蒸气蒸馏的作用是__________________。可通过________(填操作)进一步提纯 2-硝基-1,3-苯二酚。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mLNH4HCO3和Na2CO3的混合溶液分为五等分,取一份加入含amol氢氧化钠的溶液恰好反应完全,另取一份加入含bmolHCl的盐酸恰好反应至不再产生CO2,则该混合溶液中c(Na+)为( )
A. (![]() )molL-1
)molL-1
B. (2b-a)molL-1
C. (5b-![]() )molL-1
)molL-1
D. (10b-5a)molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
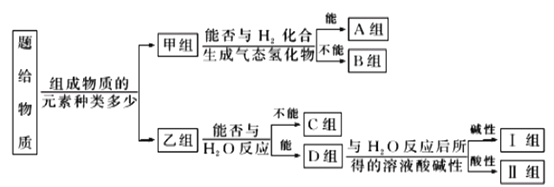
【题目】现有NH3、CO、Na、Na2O2、Fe、NO、NO2、F2、SO2、SOCl2等物质,根据它们的组成及性质进行如下分类:
请回答下列问题:
(1)图中所示的分类方法叫___________。
(2)淡黄色固体最终位于__________组,它的电子式为___________。
(3)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有8×6.02×1023个电子转移,则有__g该物质参与反应。
(4)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式___________。
(5)II组某种物质能与水发生氧化还原反应,该反应中被氧化元素与被还原的元素的质量比为___________。
(6)II组另有一种物质滴入水中后与水剧烈反应,元素化合价不发生变化,该物质与水反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如图所示。
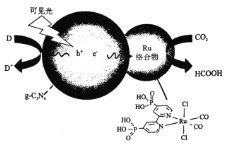
(1)基态碳原子的价电子排布图为_____________。
(2)1molHCOOH中含有的σ键数目为_____________,HCOOH的沸点比CO2高的原因为_____________。
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为_____________
(4)Ru络合物中与Ru配位的原子有N、_____________。
(5)Ru络合物含有的片段![]() 和
和![]() 中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是_____________(填“前者”或“后者”)。
中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是_____________(填“前者”或“后者”)。
(6)一种类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。

①g-C3N4中氮原子的杂化类型是_____________。
②根据图2,在图1中用平行四边形画出一个最小重复单元。_____________
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为____g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物结构如图,下列说法中正确的是![]()

A. 该物质的化学式为C15H8O8BrCl
B. 该物质能与![]() 溶液发生显色反应
溶液发生显色反应
C. 1mol该物质最多能与3mol溴水发生加成反应
D. 一定条件下,1mol该物质最多能与8molNaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com