
����Ŀ�������仯�����ǿ�ѧ����һֱ��̽�������⣬�����ڹ�ũҵ�������������������Ҫ�����á��ش��������⡣
��.��֪H��H���ļ���Ϊa kJ��mol-1��N��H���ļ���ΪbkJ��mol-1��N![]() N���ļ�����ckJ��mol-1����ӦNH3(g)
N���ļ�����ckJ��mol-1����ӦNH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)����H=____kJ��mol-1������ij�¶�����ƽ�ⳣ��ΪK����N2(g)+3H2(g)
H2(g)����H=____kJ��mol-1������ij�¶�����ƽ�ⳣ��ΪK����N2(g)+3H2(g)![]() 2NH3(g)��ƽ�ⳣ��K1=____����K��ʾ����
2NH3(g)��ƽ�ⳣ��K1=____����K��ʾ����
��.һ�Ȱ������Ȱ������Ȱ�(NH2Cl��NHCl2��NCl3)�dz��õ�����ˮ������������
��1����Cl2��NH3��Ӧ�Ʊ����Ȱ��ķ���ʽΪ3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g)�����ݻ���Ϊ1L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T�棩�����зֱ����2molCl2��2molNH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
NCl3(l)+3HCl(g)�����ݻ���Ϊ1L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T�棩�����зֱ����2molCl2��2molNH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
t/min | 0 | 40 | 80 | 120 | 160 |
�ף�400�棩n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
�ң�T�棩n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
��T��___400�棨�>����<�������÷�Ӧ����H___0���>����<������
�ڸ÷�Ӧ�Է��е�������____������¡����¡��κ��¶ȣ���
�۶Ը÷�Ӧ������˵����ȷ����___����ѡ����ĸ����
A���������������ܶȲ��䣬�������Ӧ�ﵽƽ��״̬
B����������Cl2��NH3���ʵ���֮��Ϊ3��1���������Ӧ�ﵽƽ��״̬
C����Ӧ��ƽ��������������䣬����һ������NCl3��ƽ�⽫���淴Ӧ�����ƶ�
D����Ӧ�ﵽƽ��������������䣬��ԭ�����а�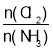 =1��������һ������Ӧ�����ƽ���Cl2��ת��������
=1��������һ������Ӧ�����ƽ���Cl2��ת��������
��2����ҵ�Ͽ����÷�Ӧ2Cl2(g)+NH3(g)![]() NHCl2 (l)+2HCl(g)�Ʊ����Ȱ���
NHCl2 (l)+2HCl(g)�Ʊ����Ȱ���
��NHCl2�����ԡ����Ի����лᷢ��ǿ��ˮ�⣬���ɾ���ǿɱ�����õ����ʣ�д���÷�Ӧ�Ļ�ѧ����ʽ____��
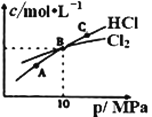
���ں��������£���2molCl2��1molNH3����ij�ܱ������з���������Ӧ�����ƽ��ʱCl2��HCl�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ����A��B��C������Cl2ת������ߵ���___�㣨�A����B����C������B��ʱ��Ӧ��ת���ʣ���(Cl2)___��(NH3)���>����=����<��������B��ƽ�����Ϊ2L����ƽ�ⳣ��K=____��
���𰸡�3b-![]() c-
c-![]() a
a ![]() > < ���� AD NHCl2+2H2O=2HClO+NH3 C = 4
> < ���� AD NHCl2+2H2O=2HClO+NH3 C = 4
��������
��.�ʱ�=��Ӧ����ܼ���-��������ܼ��ܣ��ݴ˼��㣬ƽ�ⳣ��K=![]() �����淴Ӧ��ƽ�ⳣ����Ϊ������
�����淴Ӧ��ƽ�ⳣ����Ϊ������
��.(1)���¶�Խ�ߣ���Ӧ����Խ�죻�������ݣ���400��ʱ����������ƽ���0.8mol����������1.00mol���ﵽƽ��ʱ���˵����Ӧ���ʴ�����ʣ������Ӧ�٣�����������˵���¶�����Ӱ��ƽ��������У�
�ڷ�Ӧ�Է����е��ж�����Ϊ��H-T��S��0����Ϸ�Ӧ���������жϣ�
�ۿ��淴Ӧ����ƽ��ʱ��ͬ�����ʵ�����������ȣ�����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����ٱ仯˵������ƽ�⣻
(2)�ٸ���Ԫ���غ���Ʋ������ǿ��ɱ�����õ�����ΪHClO���ݴ�д����Ӧ��
����ϵ��HCl��Ũ��Խ����Cl2ת����Խ����ʼ��2molCl2��1molNH3�����ݷ���ʽ��֪Cl2��NH3����2:1�ı������з�Ӧ������ת����ʼ����ͬ��B�㴦HCl��Cl2��Ũ����ͬ���ݴ˷��Ƹ����ʵ�Ũ�Ƚ���ƽ�ⳣ���ļ��㣻
��.��֪��H-H����ΪakJmol-1��H-N����ΪbkJmol-1��N��N���ļ���ckJmol-1�����ڷ�ӦNH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)�ġ�H=��Ӧ����ܼ���-��������ܼ���=3b-
H2(g)�ġ�H=��Ӧ����ܼ���-��������ܼ���=3b-![]() c-
c-![]() a����ƽ�ⳣ��ΪK=
a����ƽ�ⳣ��ΪK= ����N2(g)+3H2(g)2NH3(g)��ƽ�ⳣ��K1=
����N2(g)+3H2(g)2NH3(g)��ƽ�ⳣ��K1=![]() ���ʴ�Ϊ��3b-
���ʴ�Ϊ��3b-![]() c-
c-![]() a��
a��![]() ��
��
��.(1)���¶�Խ�ߣ���Ӧ����Խ�죬ƽ�������ȷ�Ӧ�����ƶ�������������ͬʱ��T��ʱ�ķ�Ӧ���ʱ�400��ʱ�ķ�Ӧ���ʿ죬��T����400�����������ݣ���400��ʱ����������ƽ���0.8mol����������1.00mol���ﵽƽ��ʱ���˵����Ӧ���ʴ�����ʣ������Ӧ�٣�����������˵���¶�����Ӱ��ƽ��������У���H��0���ʴ�Ϊ��>��<��
��3Cl2(g)+NH3(g)NCl3(l)+3HCl(g)����Ӧ�ġ�S��0����H��0�������H-T��S��0����Ҫ�����£���Ӧ���Է����У��ʴ�Ϊ�����£�
��A��NCl3(l)ΪҺ�壬��Ӧǰ�����������仯������������䣬�������������ܶȲ��䣬�������Ӧ�ﵽƽ��״̬����A��ȷ��
B����ʼ��2molCl2��2molNH3�����ݷ���ʽ��֪��Ӧ������Cl2��NH3����3:1�ı������з�Ӧ�����������ڵ�Cl2��NH3���ʵ���֮�Ȳ�����Ϊ3��1����B����
Cspan>����Ӧ�ﵽƽ��������������䣬����һ������NCl3(l)ΪҺ�岻Ӱ���ƽ����ƶ�����C����
D����Ӧ�ﵽƽ��������������䣬��ԭ�����а�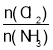 =1��������һ������Ӧ�ѹǿ����ƽ��������У�Cl2��ת��������D��ȷ��
=1��������һ������Ӧ�ѹǿ����ƽ��������У�Cl2��ת��������D��ȷ��
�ʴ�Ϊ��AD��
(2)�ٸ���Ԫ���غ���Ʋ������ǿ��ɱ�����õ�����ΪHClO�����Զ��Ȱ���ˮ��Ӧ����ʽΪ��NHCl2+2H2O=2HClO+2NH3��
������Ϊ�ܱ���������ͼ��֪C�㴦HCl��Ũ�������ϵ��HCl��Ũ��Խ����Cl2ת����Խ������C��Cl2ת������ߣ���ʼ��2molCl2��1molNH3�����ݷ���ʽ��֪Cl2��NH3����2:1�ı������з�Ӧ������ת����ʼ����ͬ��B�㴦HCl��Cl2��Ũ����ͬ����ƽ��ʱc(HCl)=amol/L����ʼc(Cl2)=![]() ��c(NH3)=
��c(NH3)=![]() ����
����

����1-a=a�����a=0.5mol/L������ƽ��ʱc(HCl)=0.5mol/L��c(Cl2)=0.5mol/L��c(NH3)=0.25mol/L��ƽ�ⳣ��K=![]() ���ʴ�Ϊ��C��=��4��
���ʴ�Ϊ��C��=��4��


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ϸ��ˮƽ������Ч��������״����(2019��nCOV)�ĸ�Ⱦ����ṹ��ͼ��ʾ������˵���������
A.��̬C1ԭ�ӵĺ��������17���˶�״̬
B.C��N��O��P����Ԫ���е縺��������O
C.H3PO4��������ԭ�ӵļ۲���Ӷ���Ϊ4
D.������H2�����ӳɷ�Ӧ�÷���������̼ԭ�Ӹ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ס��顢����Ԫ�ؼ��仯�������ִ�ũҵ���Ƽ�����������������������ص���;��
(1)��̬��ԭ���к������ռ������ܲ�ķ���Ϊ__�����ܲ��ԭ�ӹ������__����
(2)����һ���⻯��N2H4��һ�����õĻ������ȼ�ϣ���ͳ�Ʊ��µķ����ǣ�NaClO+2NH3=N2H4+NaCl+H2O����֪�µ��۵㡢�е�ֱ�Ϊ1.4����113.5�����������۵㡢�е�ֱ�Ϊ-77.7����-33.5����
��N2H4�е�ԭ�ӵ��ӻ��������Ϊ__�ӻ�����̬Nԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ___�Ρ�
�����백���۵㡢�е��������Ҫ��ԭ����__��
(3)��������һ�ֳ������壬������[Co(NH3)6]3+�д��ڵĻ�ѧ����__(�����)��
A.���Ӽ� B.���Լ� C.��λ�� D.���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�����ȷ����
A.����������ʴ�е�������Ӧ��4OH 4e-=2H2O +O2��
B.��ҵ���õ�ⷨ��þ��MgCl2(����)![]() Mg+Cl2��
Mg+Cl2��
C.ʹpH��ֽ����ɫ����Һ�У�Na����Mg2����ClO����HSO3-�ܴ�������
D.![]() ��0.1 mol��L��1����Һ�У�Na����HCO3-��K����NO3-�ܴ�������
��0.1 mol��L��1����Һ�У�Na����HCO3-��K����NO3-�ܴ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. ���¡���ѹ�£�4.6 g NO2��N2O4��������к��е���ԭ����ĿΪ0.2NA
B. 1 mol���ǻ���1 mol������������������������Ϊ10NA
C. ��0.1 mol FeCl3����1 Lˮ�У�������Һ��Fe3��������ĿΪ0.1NA
D. �ڸ����£�1 mol Fe��������ˮ������Ӧ��ת�Ƶ��ӵ���ĿΪ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
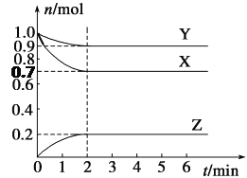
����Ŀ��ij�¶��£���2 L���ܱ������У�X��Y��Z����������ʱ��仯��������ͼ��ʾ��
��ش��������⣺
(1)��ͼ�����ݸ÷�Ӧ�Ļ�ѧ����ʽΪ_____________________��
(2)��Ӧ��ʼ��2 min��Z��ƽ����Ӧ����Ϊ____����ʱX��ת����Ϊ_____��
(3)5 minʱZ������������6 minʱZ������������Ƚϣ�ǰ��______����(����ڡ�����С�ڡ����ڡ�)��
(4)���ڸ÷�Ӧ������������Ӧ���ʵĵĴ�ʩ��________
A.���������ݻ� B.���߲���Y C.ͨ�����X D.�����¶� E.�Ӵ���
(5)�˷�Ӧ�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ:
��v(X)=6mol/(L��min) ��v(Y)= 6 mol/(L��min) ��v(Z)=8 mol/(L��min)
���з�Ӧ����������________(����)��
(6)���и�����������˵��������Ӧ�ﵽƽ�����______(����ĸ)��
a.���������ܶȲ���
b.��������ѹǿ����
c.ͬһ���ʵ�����Ӧ���ʵ����淴Ӧ����
d.X��Ũ�ȱ��ֲ���
e.����1 mol Z��ͬʱ����1.5 mol X
f.X��Y��Z�ķ�Ӧ����֮��Ϊ3��1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ�~����Ԫ�أ��ش��������⣺
�������� | I A | II A | III A | IV A | V A | VI A | VII A | 0�� |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
4 | �� | �� |
(1)Ԫ�آٵ�������______��Ԫ�آ������ڱ�������λ��________��
(2)Ԫ�آڵļ��⻯��ĽṹʽΪ________��
(3)�õ���ʽ��ʾԪ�آ���ߵĻ�������γɹ��̣�__________________��
(4)��ʾ����ᰴԭ�Ӹ�����1:1�γɵĻ�����ĵ���ʽ��______���û������к��еĻ�ѧ��������______��
(6)�ܡ��ޡ��ߡ�������Ԫ���γɵļ����ӣ����Ӱ뾶�ɴ�С��˳����_____(�������ӷ��ű�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ʵ����������Cu(NO3)2����Һʱ������Cu(NO3)2���������ڽ�Ũ�������У���������ˮϡ�͵������Ũ�ȣ���Ŀ����_________
��2��FeCl3��ˮ��ԭ���ǣ������ӷ���ʽ��ʾ��_________��AlCl3��Һ���ɣ����գ����õ�����Ҫ���������______��д��ѧʽ��
��3����֪�����Ƕ�Ԫ���ᣬ�����²��0.1mol/L��KHC2O4��pHΪ4.8,���KHC2O4��Һ��c(C2O42-)____c(H2C2O4) (����ڡ���С�ڡ����ڡ���
��4����ĭ�������װ��NaHCO3������Һ������Һ���ּ��Ե�ԭ���ǣ������ӷ���ʽ��ʾ��______ �����������һ������װ��Al2(SO4)3��Һ������Һ�����Ե�ԭ���ǣ������ӷ���ʽ��ʾ��_______��������ʧ��ʱ��ʹ��ĭ�����������ҡ������ʹҩҺ��ϣ���������İ�ɫ��ĭ����ֹ�������ӣ�����ص����ӷ���ʽΪ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ʵ������Ũ������Ҵ���һ���¶����Ʊ���ϩ��ijѧϰС�����ʵ����������װ��֤��Ũ�����ڸ÷�Ӧ�еĻ�ԭ������SO2�����Ʊ�1��2-�������顣
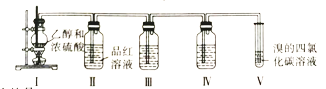
����˵����ȷ����
A.Ũ�����ڸ÷�Ӧ����Ҫ�����Ǵ�������ˮ��
B.װ��III��IV�е��Լ�����Ϊ���Ը��������Һ��Ʒ����Һ
C.ʵ����Ϻ�����ȡ��Һ��������1��2-��������
D.װ��II��Ʒ����Һ��ɫ������SO2�Ļ�ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com