
【题目】下列表述正确的是
A.钢铁吸氧腐蚀中的正极反应:4OH 4e-=2H2O +O2↑
B.工业上用电解法制镁:MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
C.使pH试纸显蓝色的溶液中:Na+、Mg2+、ClO-、HSO3-能大量共存
D.![]() =0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-能大量共存
=0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-能大量共存
科目:高中化学 来源: 题型:
【题目】一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如图所示。
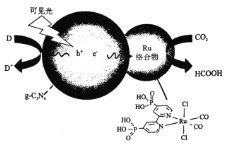
(1)基态碳原子的价电子排布图为_____________。
(2)1molHCOOH中含有的σ键数目为_____________,HCOOH的沸点比CO2高的原因为_____________。
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为_____________
(4)Ru络合物中与Ru配位的原子有N、_____________。
(5)Ru络合物含有的片段![]() 和
和![]() 中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是_____________(填“前者”或“后者”)。
中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是_____________(填“前者”或“后者”)。
(6)一种类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。

①g-C3N4中氮原子的杂化类型是_____________。
②根据图2,在图1中用平行四边形画出一个最小重复单元。_____________
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为____g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物结构如图,下列说法中正确的是![]()

A. 该物质的化学式为C15H8O8BrCl
B. 该物质能与![]() 溶液发生显色反应
溶液发生显色反应
C. 1mol该物质最多能与3mol溴水发生加成反应
D. 一定条件下,1mol该物质最多能与8molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 28g乙烯、丙烯的混合气体中所含原子数为6NA
B. 28g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2 L氯仿(CHCl3)所含分子数为0.5 NA
D. 78g苯中含有C—C键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用于治疗阿尔茨海默病的某种药物中间体H的合成路线如图所示:
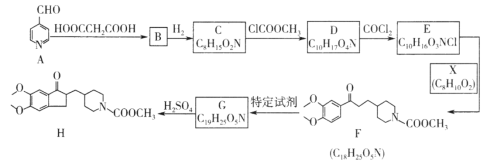
已知:i.![]()
ii.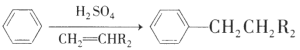
(1)A中含氧官能团的名称是___________;B→C的反应类型是______________。
(2)G的结构简式是___________________。
(3)E→F的化学方程式是______________________。
(4)芳香化合物Y是X的同分异构体,1molY可与2molNaOH反应,Y共有__________种(不含立体结构),其中核磁共振氢谱为4组峰,峰面积比为1:6:2:1的结构简式是______________________。
(5)设计由乙醇和HOOCCH2COOH制备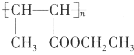 的合成路线(无机试剂任选)。__________
的合成路线(无机试剂任选)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学设计实验探究碳、硅元素的非金属性的相对强弱,实验装置如图。根据要求完成下列各题。
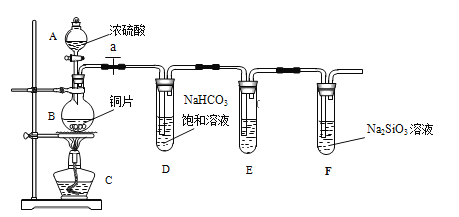
(1)填写所示仪器名称:A__________,B__________。
(2)实验步骤:连接仪器、______________、加药品后,打开 a、滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中装的是酸性KMnO4溶液,其作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________________。
③依据试管 D 中的反应,能否证明S的非金属性强于C的非金属性___(填 “能”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
Ⅰ.已知H—H键的键能为a kJ·mol-1,N—H键的键能为bkJ·mol-1,N![]() N键的键能是ckJ·mol-1,则反应NH3(g)
N键的键能是ckJ·mol-1,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的ΔH=____kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)
H2(g)的ΔH=____kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)![]() 2NH3(g)的平衡常数K1=____(用K表示)。
2NH3(g)的平衡常数K1=____(用K表示)。
Ⅱ.一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的饮用水二级消毒剂。
(1)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃___400℃(填“>”或“<”),该反应的ΔH___0(填“>”或“<”)。
②该反应自发行的条件是____(填高温、低温、任何温度)。
③对该反应,下列说法正确的是___(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达平衡后,其他条件不变,加入一定量的NCl3,平衡将向逆反应方向移动
D.反应达到平衡后,其他条件不变,在原容器中按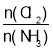 =1继续充入一定量反应物,达新平衡后Cl2的转化率增大
=1继续充入一定量反应物,达新平衡后Cl2的转化率增大
(2)工业上可利用反应2Cl2(g)+NH3(g)![]() NHCl2 (l)+2HCl(g)制备二氯胺。
NHCl2 (l)+2HCl(g)制备二氯胺。
①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出该反应的化学方程式____。
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是___点(填“A”“B”或“C”);B点时反应物转化率:α(Cl2)___α(NH3)(填“>”“=”或“<”),若B点平衡体积为2L,则平衡常数K=____。
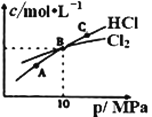
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种溶液,进行如下操作:则甲、乙、丙三种溶液可能是( )
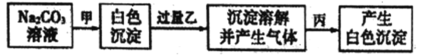
A.BaCl2、H2SO4、MgCl2B.BaCl2、HCl、Na2SO4
C.CaCl2、HNO3、NaClD.CaCl2、HNO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险.如图是氟离子电池工作示意图,其中充电时 F-从乙电极流向甲电极,下列关于该电池的说法正确的是
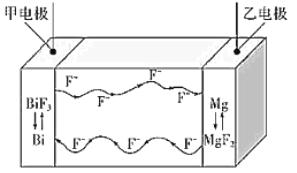
A.放电时,甲电极的电极反应式为 Bi-3e-+3F-=BiF3
B.充电时,导线上每通过1 mol e-,甲电极质量增加 19 g
C.放电时,乙电极电势比甲电极高
D.充电时,外加电源的正极与乙电极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com