
【题目】氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险.如图是氟离子电池工作示意图,其中充电时 F-从乙电极流向甲电极,下列关于该电池的说法正确的是
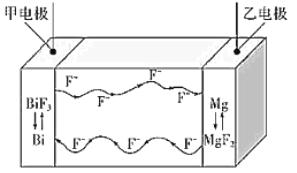
A.放电时,甲电极的电极反应式为 Bi-3e-+3F-=BiF3
B.充电时,导线上每通过1 mol e-,甲电极质量增加 19 g
C.放电时,乙电极电势比甲电极高
D.充电时,外加电源的正极与乙电极相连
【答案】B
【解析】
充电时F-从乙电极流向甲电极,则充电时,甲电极为电解池的阳极,电极反应式为Bi+3F- -3e-═BiF3,乙电极为阴极,反应式为MgF2+2e-═Mg+2F-,又充电时,电解池的阳极、阴极与原电池的正极、负极对应,所以放电时,乙电极为负极,Mg失去电子结合F-生成MgF2,电极反应式为Mg+2F--2e-═MgF2,甲电极为正极,正极反应式为BiF3+3e-═Bi+3F-,据此分析解答。
A.放电时,甲为正极,正极的反应式为BiF3+3e-═Bi+3F-,故A错误;
B.充电时,甲电极为阳极,电极反应式为Bi+3F- -3e-═BiF3,所以导线上每通过1mol e-,增加1molF-,则甲电极质量增加1mol×19g/mol=19g,故B正确;
C.放电时,乙电极为负极,甲为正极,所以乙电极电势比甲电极低,故C错误;
D.充电时,外加电源的正极与甲电极相连,故D错误;
故选B。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A.钢铁吸氧腐蚀中的正极反应:4OH 4e-=2H2O +O2↑
B.工业上用电解法制镁:MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
C.使pH试纸显蓝色的溶液中:Na+、Mg2+、ClO-、HSO3-能大量共存
D.![]() =0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-能大量共存
=0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室在配制Cu(NO3)2的溶液时,常将Cu(NO3)2固体先溶于较浓的硝酸中,再用蒸馏水稀释到所需的浓度,其目的是_________
(2)FeCl3净水的原理是(用离子方程式表示)_________将AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是______(写化学式)
(3)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则此KHC2O4溶液中c(C2O42-)____c(H2C2O4) (填“大于”或“小于”或“等于”)
(4)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈现碱性的原因是(用离子方程式表示)______ ;灭火器内另一容器中装有Al2(SO4)3溶液,该溶液呈酸性的原因是(用离子方程式表示)_______,当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
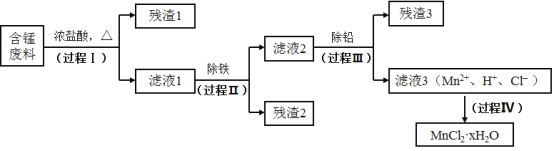
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程:
资料a.Mn的金属活动性强于Fe,Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是_____________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无蓝色沉淀生成;另取少量滤液1于试管中,_____________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.......
写出c的离子方程式:_____________。
(2)过程Ⅱ的目的是除铁。有如下两种方法:
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物......。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②补全ⅱ中的操作:_____________。
③两种方法比较,氨水法除铁的缺点是_____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是_____________。
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。则x=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-氯丙烷和2-氯丙烷分别与NaOH乙醇溶液共热的反应,下列有关说法不正确的是( )
A. 产物相同B. 碳氢键断裂的位置相同
C. 反应类型相同D. 1-氯丙烷和2-氯丙烷都能与NaOH水溶液共热的发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[Cux(OH)yClz·mH2O]是重要的农药、医药中间体,还可用作木材防腐剂、饲料添加剂等.研究小组在实验室用某厂废铜渣(主要成分为 Cu、CuO,含少量 Fe3O4、Ni、Al2O3)制备碱式氯化铜的流程如下,回答下列问题:
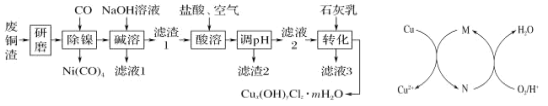
(1)“研磨”的目的为________。
(2)“碱溶”的目的为____________。
(3)“酸溶”时生成 Fe3+反应的离子方程式为_______;生成的 Fe3+对 Cu 发生的氧化反应的催化原理如上图所示。N 代表的物质为________(填化学式或离子符号)。
(4)“酸溶”时温度不能过高的理由为_________。
(5)若滤液 2 中 c(Fe3+)=4×10-8 mol/L,pH=4,则 Ksp[Fe(OH)3]=__________。
(6)为测定 Cux(OH)yClz·mH2O 的组成,进行如下操作:取样品 23.25 g,用适量酸溶解后配成 100mL 溶液;取 10.00 mL 溶液加入足量 AgNO3 溶液,生成 1.435 g 沉淀;另取 10.00 mL 溶液,用 1.000 mol/L的 EDTA 标准液滴定 Cu2+(Cu2+与 EDTA 以物质的量之比 1∶1 反应),滴定至终点时消耗标准液体积为 20.00 mL。
①溶解样品所用酸的化学式为________;
②最终确定该样品的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知实验室用浓硫酸和乙醇在一定温度下制备乙烯,某学习小组设计实验利用以下装置证明浓硫酸在该反应中的还原产物有SO2,并制备1,2-二溴乙烷。
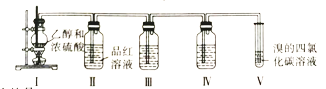
下列说法正确的是
A.浓硫酸在该反应中主要作用是催化剂、脱水剂
B.装置III、IV中的试剂依次为酸性高锰酸钾溶液、品红溶液
C.实验完毕后,采用萃取分液操作分离1,2-二溴乙烷
D.装置II中品红溶液褪色体现了SO2的还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol CH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101 kPa,120℃),其总质量为72 g,下列有关叙述不正确的是( )
A.产物的平均摩尔质量为24 g/mol
B.反应中消耗的氧气为56 g
C.若将产物通过浓硫酸充分吸收后恢复至(101 kPa,120℃),则压强变为原来的三分之一
D.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是
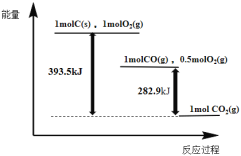
A.1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ
B.由C→CO的热化学方程式为:2C(s)+O2(g) = 2CO(g) ΔH= 221.2 kJmol1
C.反应2CO(g)+O2(g) =2CO2(g)中,生成物的总能量大于反应物的总能量
D.将1 mol C(s)磨成粉末后,反应更加剧烈,说明粉碎可以改变ΔH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com