
【题目】(1)向0.01 mol/L的NH4Cl溶液中分别加入少量的KOH固体、浓盐酸、FeCl3固体、Na2CO3固体,使NH4+水解平衡移动的方向分别为_____、_____、_____、____(填“右”“左”或“不移动”)
(2)写出Na2CO3溶液中的三大守恒规律
电荷守恒:_____________________;
物料守恒:_____________________;
质子守恒:_____________________。
【答案】右 左 左 右 c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
【解析】
(1)NH4Cl在溶液中存在水解平衡:NH4++H2O![]() NH3·H2O+H+,根据加入的电解质电离产生的微粒与该平衡微粒的关系分析其对水解平衡移动的影响;
NH3·H2O+H+,根据加入的电解质电离产生的微粒与该平衡微粒的关系分析其对水解平衡移动的影响;
(2)电荷守恒就是溶液中所有阳离子带有的正电荷总数与所有阴离子带有的负电荷总数相等;
物料守恒就是溶液中Na+的总数为所有含C元素的微粒的总数的2倍;
质子守恒就是水电离产生的H+与OH-数目相等。
(1)NH4Cl在溶液中存在水解平衡:NH4++H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
加入少量的KOH固体,KOH电离产生OH-,会消耗NH4+水解产生的H+,使溶液中c(H+)减小,水解平衡正向移动,对NH4+水解平衡起促进作用,水解平衡向右移动;
加入少量浓盐酸,盐酸电离产生H+,使溶液中c(H+)增大,对该平衡起抑制作用,水解平衡向左移动;
加入少量FeCl3固体,该盐是强酸弱碱盐,Fe3+水解产生H+,使溶液中c(H+)增大,水解平衡向左移动;
由于Na2CO3是强碱弱酸盐,CO32-水解消耗水电离产生的H+,使溶液显碱性,所以加入少量Na2CO3固体,相当于向溶液中加入了少量的碱,溶液中的OH-会消耗NH4+水解产生的H+,使水解平衡正向移动,即水解平衡向右移动;
(2) Na2CO3溶液中阳离子有Na+、H+,阴离子有CO32-、HCO3-、OH-,由于溶液显中性,说明溶液中阳离子带有的正电荷总数与所有阴离子带有的负电荷总数相等,所以有关系式:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);
根据化学式Na2CO3的电离方程式Na2CO3=2Na++CO32-可知:Na+的数目是CO32-的2倍,CO32-在溶液的存在形式有CO32-、HCO3-、H2CO3,因此有关系式:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);
在任何物质的水溶液中水电离产生的H+与OH-数目相等。Na2CO3是强碱弱酸盐,在溶液中CO32-水解时溶液显碱性,所有溶液中c(OH-)=c(H+)剩余+ c(H+)消耗= c(H+)+c(HCO3-)+2c(H2CO3),这个式子就是Na2CO3溶液中的质子守恒式。


科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)命名下列有机物:
CH3CHOHCH3____________
HOCH2CH2CHO____________
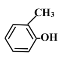 _________________
_________________
(2)燃烧某有机物A 1.50 g,生成1.12 L(标准状况)CO2和0.05 mol H2O,该有机物的蒸气对空气的相对密度是1.04,则该有机物的分子式为_____。
(3)已知端炔烃在催化剂存在下可发生偶联反应:![]() +H2, 称为Glaser反应,回答下列问题:
+H2, 称为Glaser反应,回答下列问题:
已知: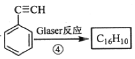 ,该转化关系的产物E(C16H10)的结构简式是_______,用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气____mol。
,该转化关系的产物E(C16H10)的结构简式是_______,用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气____mol。
(4)已知 可简写为
可简写为 ,现有某化合物W的分子结构可表示为
,现有某化合物W的分子结构可表示为![]()
![]() 的一氯代物有______种
的一氯代物有______种![]()
![]() 下列有关W的说法不正确的是______
下列有关W的说法不正确的是______![]() 填编号
填编号![]() ;
;
a.能发生还原反应
b.能发生氧化反应
c.等质量的W与苯分别完全燃烧所消耗的氧气量,前者大
d.与苯互为同分异构体
![]() 写出W的芳香族同分异构体
写出W的芳香族同分异构体![]() 能发生聚合反应
能发生聚合反应![]() 的结构简式_________;该聚合反应的化学方程式为_________;
的结构简式_________;该聚合反应的化学方程式为_________;
![]() 属于______
属于______![]() 填编号
填编号![]() 。
。
![]() 芳香烃
芳香烃![]() 环烃
环烃![]() 不饱和烃
不饱和烃![]() 炔烃
炔烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,X、Y、Z三种气体随时间变化的曲线如图所示。
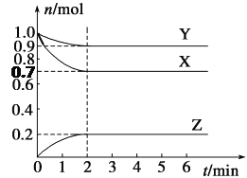
请回答下列问题:
(1)由图中数据该反应的化学方程式为_____________________。
(2)反应开始至2 min,Z的平均反应速率为____,此时X的转化率为_____。
(3)5 min时Z的生成速率与6 min时Z的生成速率相比较,前者______后者(填“大于”、“小于”或“等于”)。
(4)对于该反应,能增大正反应速率的的措施是________
A.增大容器容积 B.移走部分Y C.通入大量X D.升高温度 E.加催化剂
(5)此反应在三种不同情况下的反应速率分别为:
①v(X)=6mol/(L·min) ②v(Y)= 6 mol/(L·min) ③v(Z)=8 mol/(L·min)
其中反应速率最快的是________(填编号)。
(6)下列各项中不可以说明上述反应达到平衡的是______(填字母)。
a.混合气体的密度不变
b.混合气体的压强不变
c.同一物质的正反应速率等于逆反应速率
d.X的浓度保持不变
e.生成1 mol Z和同时生成1.5 mol X
f.X、Y、Z的反应速率之比为3∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.1 mol![]() 的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
(1)有人称溶液①是油污的“清道夫”,原因是_____________________(用离子方程式解释)
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)______________________
(3)向④中加入少量氯化铵固体,此时![]() 的值___________(填“增大”“减小”或“不变”)。
的值___________(填“增大”“减小”或“不变”)。
(4)等体积混合③和④的溶液,此时溶液中[NH4+]+[NH3·H2O]=_____________mol·L-1(填数值);此时溶液中离子浓度的大小顺序是:__________________________;若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
(5)将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室在配制Cu(NO3)2的溶液时,常将Cu(NO3)2固体先溶于较浓的硝酸中,再用蒸馏水稀释到所需的浓度,其目的是_________
(2)FeCl3净水的原理是(用离子方程式表示)_________将AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是______(写化学式)
(3)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则此KHC2O4溶液中c(C2O42-)____c(H2C2O4) (填“大于”或“小于”或“等于”)
(4)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈现碱性的原因是(用离子方程式表示)______ ;灭火器内另一容器中装有Al2(SO4)3溶液,该溶液呈酸性的原因是(用离子方程式表示)_______,当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的恒容密闭容器中发生反应![]() 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为![]()
B.该反应在10 min后才达到平衡
C.平衡状态时,![]()
D.物质B的平衡转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程:
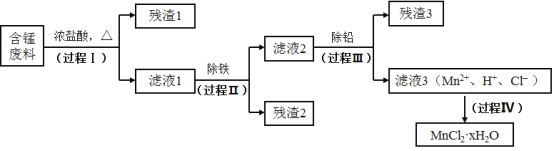
资料a.Mn的金属活动性强于Fe,Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是_____________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无蓝色沉淀生成;另取少量滤液1于试管中,_____________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.......
写出c的离子方程式:_____________。
(2)过程Ⅱ的目的是除铁。有如下两种方法:
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物......。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②补全ⅱ中的操作:_____________。
③两种方法比较,氨水法除铁的缺点是_____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是_____________。
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。则x=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[Cux(OH)yClz·mH2O]是重要的农药、医药中间体,还可用作木材防腐剂、饲料添加剂等.研究小组在实验室用某厂废铜渣(主要成分为 Cu、CuO,含少量 Fe3O4、Ni、Al2O3)制备碱式氯化铜的流程如下,回答下列问题:
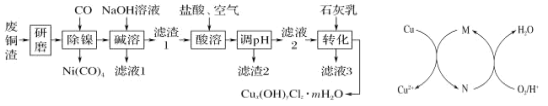
(1)“研磨”的目的为________。
(2)“碱溶”的目的为____________。
(3)“酸溶”时生成 Fe3+反应的离子方程式为_______;生成的 Fe3+对 Cu 发生的氧化反应的催化原理如上图所示。N 代表的物质为________(填化学式或离子符号)。
(4)“酸溶”时温度不能过高的理由为_________。
(5)若滤液 2 中 c(Fe3+)=4×10-8 mol/L,pH=4,则 Ksp[Fe(OH)3]=__________。
(6)为测定 Cux(OH)yClz·mH2O 的组成,进行如下操作:取样品 23.25 g,用适量酸溶解后配成 100mL 溶液;取 10.00 mL 溶液加入足量 AgNO3 溶液,生成 1.435 g 沉淀;另取 10.00 mL 溶液,用 1.000 mol/L的 EDTA 标准液滴定 Cu2+(Cu2+与 EDTA 以物质的量之比 1∶1 反应),滴定至终点时消耗标准液体积为 20.00 mL。
①溶解样品所用酸的化学式为________;
②最终确定该样品的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式__________
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称"同系物"),它们均符合通式CnH2n+2。当n=______时,这类有机物开始出现同分异构体。
(3)B具有的性质是__________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式__________
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为____;其化学方程式为__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com