
【题目】一定温度下,在2 L的恒容密闭容器中发生反应![]() 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为![]()
B.该反应在10 min后才达到平衡
C.平衡状态时,![]()
D.物质B的平衡转化率为20%
【答案】C
【解析】
A.v(C)= ,同一反应反应中反应速率之比等于计量数之比,3v(A)=v(C),所以v(A)=
,同一反应反应中反应速率之比等于计量数之比,3v(A)=v(C),所以v(A)=![]() ,故A错误;
,故A错误;
B.15min时,n(B)=1.6mol,消耗了2.4mol-1.6mol=0.8mol,根据方程式可知这段时间内消耗A的物质的量为0.4mol,所以15min时,n(A)=1.6mol,与10min时A的物质的量相同,说明10~15min这段时间内平衡没有移动,但无法确定是10min时达到平衡,还是10min前已经达到平衡,故B错误;
C.根据B选项分析可知平衡时消耗的B为0.8mol,根据方程式可知生成C的物质的量为1.2mol,浓度为![]() ,故C正确;
,故C正确;
D. 物质B的平衡转化率为![]() ,故D错误;
,故D错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】某实验小组探究SO2与AgNO3溶液的反应,实验记录如下:
序号 | Ⅰ | Ⅱ | Ⅲ |
实验 步骤 |
|
|
|
实验现象 | 得到无色溶液a和白色沉淀b | 产生无色气体,遇空气变为红棕色 | 产生白色沉淀 |
下列说法正确的是
A.透过测Ⅰ中无色溶液a的pH可以判断SO2是否被氧化
B.实验Ⅱ说明白色沉淀b具有还原性
C.实验Ⅲ说明溶液a中一定有![]() 生成
生成
D.实验Ⅰ、Ⅱ、Ⅲ说明SO2与AgNO3溶液反应既有Ag2SO4生成,又有Ag2SO3生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、二氧化碳、青霉素、硝酸钾、乙醇、氨等“分子”改变过人类的世界。
(1)铁原子在基态时,外围电子排布式为__________________________。
(2)1 mol CO2分子中含有σ键的物质的量为_________________________。
(3)6-氨基青霉烷酸的结构如图所示:
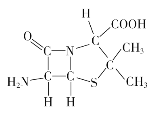
①其中C、N、O电负性由小至大的顺序是_________________。
②其中碳原子的杂化类型是______________。
(4)硝酸钾中![]() 的空间构型为___________,写出
的空间构型为___________,写出![]() 的一种等电子体的化学式______________。
的一种等电子体的化学式______________。
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是_____________。
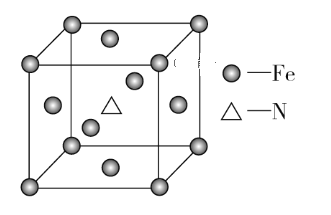
(6)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,该晶体的化学式为____________,若两个最近的Fe原子间的距离为a cm,则该晶体的密度为_________g·cm-3。(用NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究K2Cr2O7溶液中的化学平衡,设计如图所示实验。已知:Cr2O72-+H2O![]() 2CrO42-+2H+△H=+13.8kJ/mol。实验现象如下:
2CrO42-+2H+△H=+13.8kJ/mol。实验现象如下:
i.试管a中溶液为橙色;
ii.试管b中溶液为黄色;
iii.试管c中滴加浓硫酸后温度略有升高,溶液变为深橙色。
下列说法正确的是
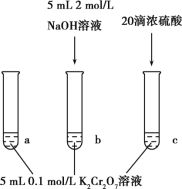
A.该反应是一个氧化还原反应
B.b试管中不存在Cr2O72-
C.该实验不能证明减小生成物浓度平衡正向移动
D.试管c中影响平衡的主要因素是温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)向0.01 mol/L的NH4Cl溶液中分别加入少量的KOH固体、浓盐酸、FeCl3固体、Na2CO3固体,使NH4+水解平衡移动的方向分别为_____、_____、_____、____(填“右”“左”或“不移动”)
(2)写出Na2CO3溶液中的三大守恒规律
电荷守恒:_____________________;
物料守恒:_____________________;
质子守恒:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4NO3 溶液受热可发生分解反应:NH4NO3![]() N2↑+HNO3+H2O(未配平)。用 NA 表示阿伏加德罗数的值,下列说法正确的是
N2↑+HNO3+H2O(未配平)。用 NA 表示阿伏加德罗数的值,下列说法正确的是
A.分解时每生成 2.24 L(标准状况)N2,转移电子的数目为 0.6NA
B.2.8 g N2 中含有共用电子对的数目为 0.3NA
C.56 g Fe 与足量稀硝酸反应生成 NO2 分子的数目为 3NA
D.0.1 mol·L-1 NH4NO3 溶液中,NH4+的数目小于 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的有机物充分燃烧,产物先通入浓硫酸,浓硫酸增重5.4 g,然后通入足量澄清石灰水中,完全吸收后,经过滤得到20 g沉淀,则该有机物可能是( )
A. 乙醇B. 乙烯C. 甲酸甲酯D. 乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A.NaHCO3在水中的电离方程式:NaHCO3 = Na++HCO![]()
B.氯化镁溶液与氨水反应的离子方程式:Mg2++2OH-= Mg(OH)2↓
C.Cl2与水反应的离子方程式:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
D.醋酸钠水解的离子方程式CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com