
【题目】
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、二氧化碳、青霉素、硝酸钾、乙醇、氨等“分子”改变过人类的世界。
(1)铁原子在基态时,外围电子排布式为__________________________。
(2)1 mol CO2分子中含有σ键的物质的量为_________________________。
(3)6-氨基青霉烷酸的结构如图所示:
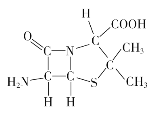
①其中C、N、O电负性由小至大的顺序是_________________。
②其中碳原子的杂化类型是______________。
(4)硝酸钾中![]() 的空间构型为___________,写出
的空间构型为___________,写出![]() 的一种等电子体的化学式______________。
的一种等电子体的化学式______________。
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是_____________。
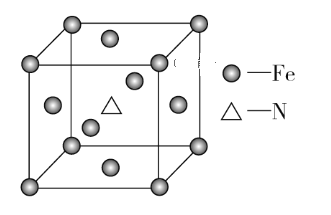
(6)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,该晶体的化学式为____________,若两个最近的Fe原子间的距离为a cm,则该晶体的密度为_________g·cm-3。(用NA表示阿伏加德罗常数的值)
【答案】3d64s2 2 mol C<N<O SP3、SP2 平面三角形 BF3(其他合理答案均可) 乙醇分子间存在氢键,氯乙烷分子间不能形成氢键,所以乙醇的沸点比氯乙烷高。 Fe4N  或
或![]()
【解析】
(1)铁是26号元素,铁原子在基态时的电子排布式是1s22s22p63s23p63d64s2;
(2)CO2分子的结构式是O=C=O;
(3)①同周期元素从左到右电负性增大;
②单键碳原子的杂化轨道数是4、双键碳原子的杂化轨道数是3;
(4)硝酸根中N原子的杂化轨道数是![]() ,无孤电子对; 等电子体是原子数相同、价电子数也相同的分子或离子;
,无孤电子对; 等电子体是原子数相同、价电子数也相同的分子或离子;
(5)乙醇分子间存在氢键;
(6)根据均摊原则计算化学式;根据晶胞图,两个最近的Fe原子间的距离为a cm,则晶胞的面对角线为2acm,晶胞边长是![]() 。
。
(1)铁是26号元素,铁原子在基态时的电子排布式是1s22s22p63s23p63d64s2,外围电子(价电子)排布式为3d64s2;
(2)单键全是σ键、双键中有1个σ键和1个π键, CO2分子的结构式是O=C=O,所以1 mol CO2分子中含有σ键的物质的量为2 mol;
(3)①同周期元素从左到右电负性增大,所以C、N、O电负性由小至大的顺序是C<N<O;
②单键碳原子的杂化轨道数是4、双键碳原子的杂化轨道数是3,6-氨基青霉烷酸中既有单键碳又有双键碳,所以碳原子的的杂化类型是sp3、sp2;
(4)硝酸根中N原子的杂化轨道数是![]() ,无孤电子对,所以硝酸根的空间构型为平面三角形;等电子体是原子数相同、价电子数也相同的分子或离子,硝酸根的价电子数是24,BF3与NO3-互为等电子体;
,无孤电子对,所以硝酸根的空间构型为平面三角形;等电子体是原子数相同、价电子数也相同的分子或离子,硝酸根的价电子数是24,BF3与NO3-互为等电子体;
(5)乙醇分子间存在氢键,氯乙烷分子间不能形成氢键,所以乙醇的沸点比氯乙烷高。
(6)由题图知,该晶胞中含有的Fe原子的个数为8×1/8+6×1/2=4,含有的N原子的个数为1,该晶体的化学式为Fe4N,该晶胞的质量为![]() g,两个最近的Fe原子间的距离为a cm,则晶胞边长
g,两个最近的Fe原子间的距离为a cm,则晶胞边长![]() cm,故该晶体的密度为
cm,故该晶体的密度为![]() g·cm-3=
g·cm-3= g·cm-3。
g·cm-3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铅蓄电池是最常见的二次电池。由于铅蓄电池的性能优良、价格低廉、安全可靠,可多次充放电,所以在生产生活中使用广泛,汽车等机动车辆多数都使用这种蓄电池。
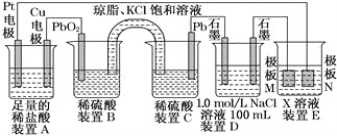
(1)装置B中PbO2上发生的电极反应方程式为______________。
(2)装置A中总反应的离子方程式为____________。
(3)盐桥中的______(填离子符号)向装置C中溶液方向移动。
(4)若装置E中的目的是精炼铜,则X为________,极板M的材料为________(填“粗铜”或“精铜”)。M电极质量改变6.4g时,N极质量变化_________6.4g,(填“大于”、 “小于”、“等于”或“无法确定”),装置D中产生的气体体积为_______L(标准状况下),溶液的pH______(填“增大”或“减小”,忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)制取铜的操作流程如下:
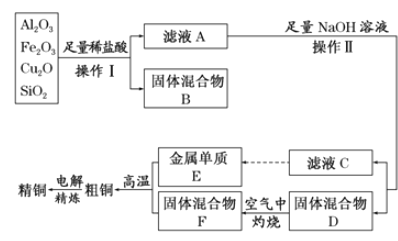
已知:Cu2O+2H+===Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为_________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为__________,检验滤液A中存在该离子的试剂为_____________(填试剂名称)。
(3)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为___________
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=________。
(5)利用电解法进行粗铜精炼时,下列叙述正确的是__________(填代号)。
a 电能全部转化为化学能
b 粗铜接电源正极,发生氧化反应
c 精铜作阴极,电解后电解液中Cu2+浓度减小
d 粗铜精炼时通过的电量与阴极析出铜的量无确定关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一氧化碳-空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中,正确的是( )
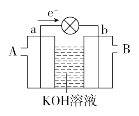
A. a电极发生还原反应,b电极发生氧化反应
B. a电极的电极反应式为CO+4OH-+2e-===CO32-+2H2O
C. A处通入的是空气,B处通入的是CO
D. 用该电池作电源精炼铜,若阴极质量增加6.4 g,至少消耗标准状况下的CO 2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,X、Y、Z三种气体随时间变化的曲线如图所示。
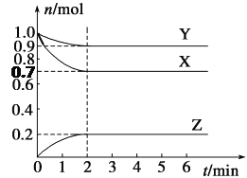
请回答下列问题:
(1)由图中数据该反应的化学方程式为_____________________。
(2)反应开始至2 min,Z的平均反应速率为____,此时X的转化率为_____。
(3)5 min时Z的生成速率与6 min时Z的生成速率相比较,前者______后者(填“大于”、“小于”或“等于”)。
(4)对于该反应,能增大正反应速率的的措施是________
A.增大容器容积 B.移走部分Y C.通入大量X D.升高温度 E.加催化剂
(5)此反应在三种不同情况下的反应速率分别为:
①v(X)=6mol/(L·min) ②v(Y)= 6 mol/(L·min) ③v(Z)=8 mol/(L·min)
其中反应速率最快的是________(填编号)。
(6)下列各项中不可以说明上述反应达到平衡的是______(填字母)。
a.混合气体的密度不变
b.混合气体的压强不变
c.同一物质的正反应速率等于逆反应速率
d.X的浓度保持不变
e.生成1 mol Z和同时生成1.5 mol X
f.X、Y、Z的反应速率之比为3∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
G是功能高分子材料。以甲苯为原料合成G的一种流程如下(部分条件和产物略去)。
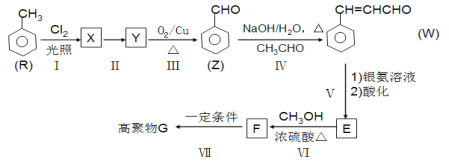
回答下列问题:
(1)W中官能团名称是:_______________________;反应Ⅰ的类型是_________________。
(2)反应Ⅱ的试剂和条件是____________、_______________;Z的名称是______________。
(3)写出F→G的化学方程式:_________________。
(4)T是E的同分异构体,T的苯环上有3个互不相同的取代基,T的结构有______种。
(5)W分子中最多有______个原子共平面。
(6)以乙醇为原料,经过三步合成正丁醇。参照上述流程图设计合成路线。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.1 mol![]() 的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
(1)有人称溶液①是油污的“清道夫”,原因是_____________________(用离子方程式解释)
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)______________________
(3)向④中加入少量氯化铵固体,此时![]() 的值___________(填“增大”“减小”或“不变”)。
的值___________(填“增大”“减小”或“不变”)。
(4)等体积混合③和④的溶液,此时溶液中[NH4+]+[NH3·H2O]=_____________mol·L-1(填数值);此时溶液中离子浓度的大小顺序是:__________________________;若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
(5)将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的恒容密闭容器中发生反应![]() 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为![]()
B.该反应在10 min后才达到平衡
C.平衡状态时,![]()
D.物质B的平衡转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
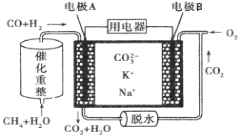
A.反应CH4+H2O![]() 3H2+CO,每消耗1mol CH4转移12mol电子
3H2+CO,每消耗1mol CH4转移12mol电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电极B上发生的电极反应为:O2+2CO2+4e-=2![]()
D.电池工作时,![]() 向电极B移动
向电极B移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com