
【题目】多年来,储氢材料、光催化剂与硼酸盐材料的研究一直是材料领域的热点研究方向。回答下列问题:
一种Ru络合物与g-C3N4符合光催化剂将CO2还原为HCOOH的原理如图。
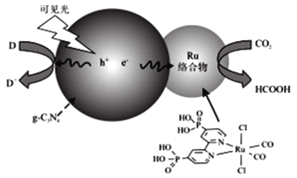
(1)Ru络合物中第二周期元素的第一电离能由大到小的顺序为___,Ru络合物含有的片段![]() 和
和![]() 中都存在大π键,氮原子的杂化方式为___,氮原子配位能力更强的是___(填结构简式)
中都存在大π键,氮原子的杂化方式为___,氮原子配位能力更强的是___(填结构简式)
(2)基态碳原子的价电子排布图为___,HCOOH的沸点比CO2高的原因是___。
(3)2019年8月13日中国科学家合成了白光材料Ba2[Sn(OH)6][B(OH)4]2,[B(OH)4]-中B的价层电子对数为____,[Sn(OH)6]2-中,Sn与O之间的化学键不可能是___。
a.π键 b.σ键 c.配位键 d.极性键
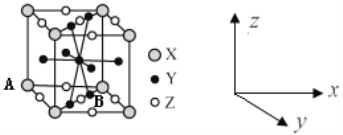
(4)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为___(填化学式)。若原子分数坐标A为(0,0,0),则B(Y)的原子分数坐标为___,已知LaNi5H6摩尔质量为499g·mol-1,晶体密度为g·cm-3,设NA为阿伏加德罗常数的值,则晶胞参数为a=___pm(用代数式表示)。
【答案】N>O>C sp2 ![]()
![]() HCOOH和CO2都为分子晶体,HCOOH分子间形成氢键 4 a H2 (
HCOOH和CO2都为分子晶体,HCOOH分子间形成氢键 4 a H2 (![]() ,
,![]() ,0)
,0) 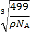 ×1010
×1010
【解析】
根据元素第一电离能的变化趋势比较元素的第一电离能的大小关系,根据杂化轨道理论和大π键的成键特点判断氮原子的轨道杂化方式,根据配位键的成键条件判断![]() 和
和![]() 中谁的氮原子配位能力更强。根据价层电子对互斥理论分析中心原子的价层电子对数,根据Sn与O的成键特点判断其所形成的化学键类型。根据均摊法确定晶胞中各种微粒的个数,再结合晶体的化学式确定微粒Z的类型,根据晶胞结构及其粒子的空间分布特点判断其坐标参数,根据晶胞的密度和质量计算晶胞的边长。
中谁的氮原子配位能力更强。根据价层电子对互斥理论分析中心原子的价层电子对数,根据Sn与O的成键特点判断其所形成的化学键类型。根据均摊法确定晶胞中各种微粒的个数,再结合晶体的化学式确定微粒Z的类型,根据晶胞结构及其粒子的空间分布特点判断其坐标参数,根据晶胞的密度和质量计算晶胞的边长。
(1)同周期从左向右元素的第一电离能总体呈增大趋势,但是第ⅤA族元素比同周期的第ⅥA族元素的第一电离能大,故N、O、C的第一电离能依次减小;![]() 和
和![]() 中都存在大π键,氮原子均采用sp2杂化,
中都存在大π键,氮原子均采用sp2杂化,![]() 的大π键为π66,N原子有一对孤电子对,
的大π键为π66,N原子有一对孤电子对,![]() 的大π键为π56,N原子无孤电子对,因此氮原子配位能力更强的是
的大π键为π56,N原子无孤电子对,因此氮原子配位能力更强的是![]() ,故答案为:N>O>C;sp2;
,故答案为:N>O>C;sp2;![]() ;
;
(2)碳原子为6号元素,根据构造原理可写出基态碳原子的电子排布式为1s22s22p2,故基态碳原子的价电子排布图为![]() ;HCOOH和CO2都为分子晶体,但是HCOOH分子间可形成氢键,故HCOOH的沸点比CO2高;
;HCOOH和CO2都为分子晶体,但是HCOOH分子间可形成氢键,故HCOOH的沸点比CO2高;
(3)[B(OH)4]-中硼原子连接四个羟基,其价层电子对数为4;[Sn(OH)6]2-的中心离子Sn4+与OH-之间形成配位键,配位键是一种特殊的共价键,则Sn与O之间形成的化学键属于σ键或极性键,不可能是π键,故答案为:4;a;
(4)根据均摊法可知,晶胞中,微粒X的个数为![]() ,微粒Y的个数为
,微粒Y的个数为![]() ,微粒Z的个数为
,微粒Z的个数为![]() ,根据储氢后所得晶体的化学式LaNi5H6,可知微粒Z为H2;根据晶胞结构图可知,B(Y)的原子分数坐标为(
,根据储氢后所得晶体的化学式LaNi5H6,可知微粒Z为H2;根据晶胞结构图可知,B(Y)的原子分数坐标为(![]() ,
,![]() ,0);晶胞边长
,0);晶胞边长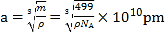 ,故答案为:H2;(
,故答案为:H2;(![]() ,
,![]() ,0);
,0);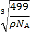 ×1010。
×1010。


科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色的配合物,是合成其它一些含钴配合物的原料。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图,回答下列问题:
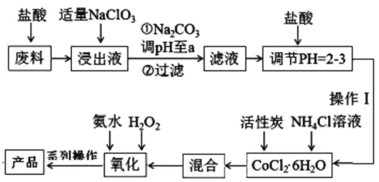
已知:①“浸出液”中含有Co2+、Fe2+、Fe3+、Al3+等
②Ksp[Co(OH)2]=6×10-15、Ksp[Co(OH)3]=1.6×10-44
(1)加“适量NaClO3”的作用是___,发生反应的离子方程式为___。
(2)“加Na2CO3调pH至a”会生成两种沉淀,分别为___(填化学式)。
(3)操作Ⅰ的步骤包括___、___、减压过滤。
(4)流程中“氧化”过程应先加入___(填“氨水”或“H2O2”),需水浴控温在50~60℃,温度不能过高,原因是___。写出“氧化”步骤发生反应的离子方程式:___,若无活性炭作催化剂,所得固体产物中除[Co(NH3)6]Cl3外还会有大量二氯化一氯五氨合钴[Co(NH3)5Cl]Cl2和三氯化五氨一水合钴[Co(NH3)5H2O]Cl3晶体,这体现了催化剂的___性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素的最高正价依次为1、4、5、7,其核电荷数按B、C、D,A的次序增大;已知B原子的次外层电子数为2,C、D、A原子的次外层电子数均为8;A原子核外电子总数不超过![]() 。试回答:
。试回答:
(1)各元素符号为:A______B______C______D______
(2)写出B、C、D最高价氧化物对应水化物的分子式:______、______、______,并比较其酸性强弱:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
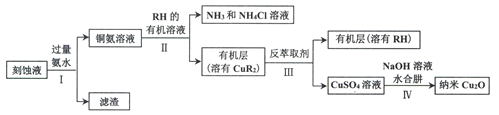
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗高磷酸盐血症。某化学小组用如图装置模拟制备碳酸镧,反应为2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O,下列说法正确的是( )
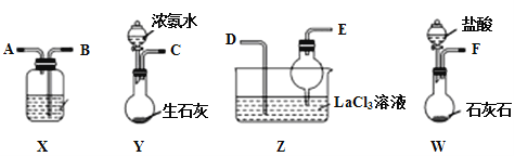
A.从左向右接口的连接顺序:F→B,A→D,E←C
B.装置X中盛放的试剂为饱和Na2CO3溶液
C.装置Z中用干燥管的主要目的是增大接触面积,加快气体溶解
D.实验开始时应先打开Y中分液漏斗的旋转活塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W、X、Y的原子最外层电子数之和为14;X与Z同族;W是空气中含量最多的元素;Z的单质为常见气体,其水溶液具有漂白性。下列说法正确的是![]()
A.X的最高正化合价为![]()
B.简单离子的半径:![]()
C.Y的单质与冷、热水均不反应
D.W、Z两元素形成的化合物![]() 为共价化合物
为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。
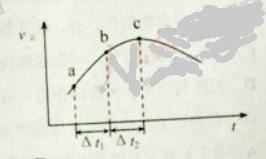
A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的二氧化硫气体和二氧化碳气体的比较中,正确的是( )
A.密度比为11∶16B.物质的量比为16∶11
C.体积比为11∶16D.分子个数比为16∶11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com