
【题目】![]() 以
以![]() 和
和![]() 为原料合成尿素是利用
为原料合成尿素是利用![]() 的成功范例。在尿素合成塔中的主要反应可表示如下:
的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:![]()
![]()
反应Ⅱ:![]()
![]()
总反应:![]()
![]()
请回答下列问题:
![]() 反应Ⅰ的
反应Ⅰ的![]() ______________。
______________。
![]() 在____
在____![]() 填“高温”或“低温”
填“高温”或“低温”![]() 情况下有利于反应Ⅱ的自发进行。
情况下有利于反应Ⅱ的自发进行。
![]() 氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以
氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以![]() 、
、![]() 、
、![]() 、
、![]() 的形式存在。
的形式存在。

![]() “溶浸”中 ZnO发生反应的离子方程式为 _______。
“溶浸”中 ZnO发生反应的离子方程式为 _______。
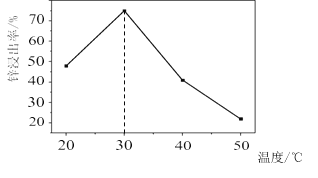
![]() 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析 ![]() 时锌浸出率最高的原因为 __________。
时锌浸出率最高的原因为 __________。
![]() “滤渣 3”的主要成分为_______________。
“滤渣 3”的主要成分为_______________。
【答案】![]() 高温
高温 ![]() 低于
低于![]() 时,溶浸反应速率随温度升高而增大;超过
时,溶浸反应速率随温度升高而增大;超过![]() ,氨气逸出导致溶浸反应速率下降
,氨气逸出导致溶浸反应速率下降 ![]() 、Cd
、Cd
【解析】
(1)![]() 依据热化学方程式和盖斯定律计算分析;
依据热化学方程式和盖斯定律计算分析;
![]() 依据反应自发进行的判断依据是△H-T△S<0分析;
依据反应自发进行的判断依据是△H-T△S<0分析;
![]() ①依据流程图可知,“溶浸”中ZnO发生反应生成
①依据流程图可知,“溶浸”中ZnO发生反应生成![]() ;
;
②低于![]() 时,浸出反应速率随温度的升高而增大;超过
时,浸出反应速率随温度的升高而增大;超过![]() 时,氨气逸出导致浸出反应速率下降;
时,氨气逸出导致浸出反应速率下降;
![]() 依据流程图可知,“滤渣3”的主要成分为锌发生置换反应的产物。
依据流程图可知,“滤渣3”的主要成分为锌发生置换反应的产物。
![]() 反应Ⅰ:2NH
反应Ⅰ:2NH![]() NH
NH![]() COONH
COONH![]() H1;
H1;
反应Ⅱ:NH![]() COONH
COONH![]()
![]() H2=+72.49KJ/mol;
H2=+72.49KJ/mol;
总反应:2NH3(g)+CO2(g)![]()
![]() H3=-86.98KJ/mol;根据盖斯定律,总反应
H3=-86.98KJ/mol;根据盖斯定律,总反应![]() 反应II,得到反应I,则H1=-86.98KJ/mol -(+72.49KJ/mol)=-159.47 KJ/mol;
反应II,得到反应I,则H1=-86.98KJ/mol -(+72.49KJ/mol)=-159.47 KJ/mol;
故答案为:-159.47 KJ/mol;
![]() 反应:NH
反应:NH![]() COONH
COONH![]()
![]() H2=+72.49KJ/mol,反应H>0,S>0,满足反应自发进行的判断依据是H-TS <0,则需要高温下反应自发进行;
H2=+72.49KJ/mol,反应H>0,S>0,满足反应自发进行的判断依据是H-TS <0,则需要高温下反应自发进行;
故答案为:高温。
![]() 依据流程图可知,“溶浸”中 ZnO发生反应的离子方程式为:
依据流程图可知,“溶浸”中 ZnO发生反应的离子方程式为:![]() ;
;
故答案为:![]() ;
;
![]() 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析![]() 时锌浸出率最高的原因为:低于
时锌浸出率最高的原因为:低于![]() 时,浸出反应速率随温度的升高而增大;超过
时,浸出反应速率随温度的升高而增大;超过![]() 时,氨气逸出导致浸出反应速率下降;
时,氨气逸出导致浸出反应速率下降;
故答案为:低于![]() 时,溶浸反应速率随温度升高而增大;超过
时,溶浸反应速率随温度升高而增大;超过![]() ,氨气逸出导致溶浸反应速率下降;
,氨气逸出导致溶浸反应速率下降;
![]() 依据流程图可知,“滤渣3”的主要成分为锌发生置换反应的产物,所以主要成分为:Cu、Cd;
依据流程图可知,“滤渣3”的主要成分为锌发生置换反应的产物,所以主要成分为:Cu、Cd;
故答案为:Cu、Cd。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:
【题目】图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
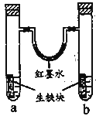
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:![]()
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是有机物 H 的合成路径。
已知: 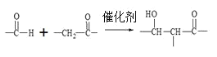
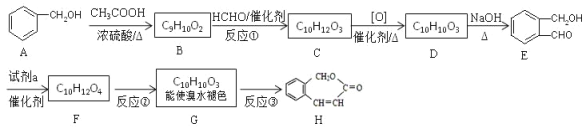
(1)①的反应类型是________。②的反应条件是_____________。
(2)试剂 a 是_________。F 的结构简式是_________。
(3)反应③的化学方程式_________。 与E互为同分异构体,能水解且苯环上只有一种取代基的结构简式是_________。(写出其中一种)
(4)A合成E为何选择这条路径来合成,而不是A和HCHO直接合成,理由是_________。
(5)根据已有知识,设计由![]() 为原料合成
为原料合成![]() 的路线_________,无机试剂任选(合成路线常用的表示方法为:X
的路线_________,无机试剂任选(合成路线常用的表示方法为:X![]() Y……
Y……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(化合物L)是人们熟知的解热镇痛药物。一种长效、缓释阿司匹林(化合物P)的合成路线如下图所示:
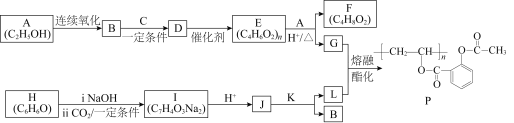
已知:①HC≡CH+RCOOH![]()
![]()
②RCOOR’+R”OH![]() RCOOR”+R’OH(R、R’、R”代表烃基)
RCOOR”+R’OH(R、R’、R”代表烃基)
请回答:
(1)A中的官能团是____________________。
(2)C的结构简式是____________________。
(3)D→E的反应类型是____________________。
(4)E→G的化学方程式是______________________________________。
(5)已知:H是芳香族化合物。在一定条件下2B → K + H2O,K的核磁共振氢谱只有一组峰。J→L的化学方程式是____________________。
(6)L在体内可较快转化为具有药效的J,而化合物P与L相比,在体内能缓慢持续释放J。
① 血液中J浓度过高能使人中毒,可静脉滴注NaHCO3溶液解毒。请用化学方程式解释NaHCO3的作用:______________________________________________________________。
② 下列说法正确的是______(填字母)。
a.P中的酯基在体内可缓慢水解,逐渐释放出J
b.P在体内的水解产物中没有高分子化合物
c.将小分子药物引入到高分子中可以实现药物的缓释功能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu组成的原电池示意图,某小组做完该实验后,在读书卡片上记录如下,卡片上描述合理的是( )
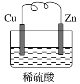
实验记录:
①导线中电流方向:Zn→Cu
②Cu极上有气泡产生,发生还原反应
③锌片变薄
实验结论:
④Zn为正极,Cu为负极
⑤正极反应式:Cu-2e-=Cu2+,发生氧化反应
⑥H+向Cu极移动,SO42-向Zn极移动
A.②③⑥B.④⑤⑥
C.③④⑤D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙烯分子里含有一个碳碳双键的事实是( )
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯能使酸性KMnO4溶液褪色
D.乙烯易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
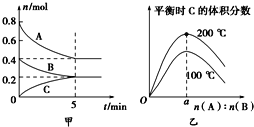
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用如图所示装置制取氯气,下列说法不正确的是
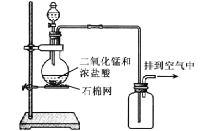
A.为了防止氯气污染空气,必须进行尾气处理
B.该装置图中存在两处明显错误
C.该实验装置中收集氯气的方法不正确
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以检验是否有氯气逸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com