
【题目】以下是有机物 H 的合成路径。
已知: 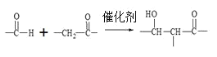
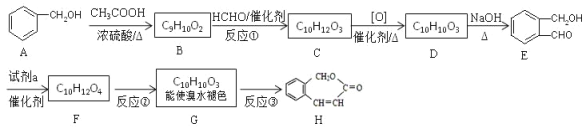
(1)①的反应类型是________。②的反应条件是_____________。
(2)试剂 a 是_________。F 的结构简式是_________。
(3)反应③的化学方程式_________。 与E互为同分异构体,能水解且苯环上只有一种取代基的结构简式是_________。(写出其中一种)
(4)A合成E为何选择这条路径来合成,而不是A和HCHO直接合成,理由是_________。
(5)根据已有知识,设计由![]() 为原料合成
为原料合成![]() 的路线_________,无机试剂任选(合成路线常用的表示方法为:X
的路线_________,无机试剂任选(合成路线常用的表示方法为:X![]() Y……
Y……![]() 目标产物)
目标产物)
【答案】加成 浓硫酸、加热 CH3COOH 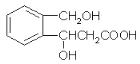

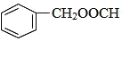 防止苯甲醇的羟基被氧化
防止苯甲醇的羟基被氧化 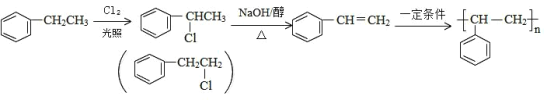
【解析】
苯甲醇和醋酸在浓硫酸催化下发生酯化反应生成B(![]() ),B和甲醛反应生成C,C催化氧化生成D,D再和NaOH溶液反应生成E(
),B和甲醛反应生成C,C催化氧化生成D,D再和NaOH溶液反应生成E(![]() ),根据E的结构简式回推,可知D→E是酯的水解,所以D为
),根据E的结构简式回推,可知D→E是酯的水解,所以D为![]() ,D是C催化氧化生成的,所以C为
,D是C催化氧化生成的,所以C为![]() ,则B和甲醛的反应是加成反应。E→F增加了2个碳原子和2个氧原子,根据给出的已知,可推测试剂a为CH3COOH,生成的F为
,则B和甲醛的反应是加成反应。E→F增加了2个碳原子和2个氧原子,根据给出的已知,可推测试剂a为CH3COOH,生成的F为 ,F生成G(能使溴水褪色),G分子中有碳碳双键,为F发生消去反应生成的,结合H的结构简式可知G为
,F生成G(能使溴水褪色),G分子中有碳碳双键,为F发生消去反应生成的,结合H的结构简式可知G为![]() 。
。
(1)①是![]() 和甲醛反应生成
和甲醛反应生成![]() ,反应类型是加成反应;②是
,反应类型是加成反应;②是 的醇羟基发生消去反应生成
的醇羟基发生消去反应生成![]() 的反应,所需试剂是浓硫酸,条件是加热;
的反应,所需试剂是浓硫酸,条件是加热;
(2)由E生成F根据分子式的变化可以推出a的结构简式是CH3COOH,F的结构简式是 ;
;
(3)反应③是![]() 的分子内酯化,化学方程式为:
的分子内酯化,化学方程式为: ;
;
E为![]() ,与E互为同分异构体,能水解,即需要有酯基,且苯环上只有一种取代基,同分异构体可以为
,与E互为同分异构体,能水解,即需要有酯基,且苯环上只有一种取代基,同分异构体可以为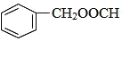 或
或![]() ;
;
(4)苯甲酸的醇羟基容易在反应过程中被氧化,A合成E选择题中路径来合成原因是防止苯甲醇的羟基被氧化;
(5)要合成![]() ,需要有单体
,需要有单体![]() ,由
,由![]() 可以制得
可以制得![]() 或
或![]() ,再发生消去反应即可得到
,再发生消去反应即可得到![]() 。故合成路线为:
。故合成路线为:


科目:高中化学 来源: 题型:
【题目】海水是可以综合利用的。从海水中提取食盐和溴的过程如下:
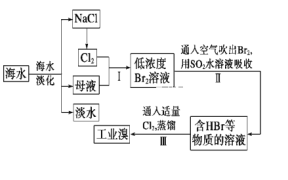
(1)请写出一种海水淡化的方法:__。
(2)步骤Ⅰ获取Br2的离子方程式为___。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是__(填化学式)。若反应中生成2molHBr,则消耗___molSO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
银盐 性质 | AgCl | AgBr | Ag2CrO4 |
颜色 | 白 | 浅黄 | 砖红 |
滴定终点的现象是______,终点现象对应的离子反应方程式为______。为了测定产品中(NH4)2Cr2O7的含量,称取样品0.1500g,置于锥形瓶中,加50mL水,再加入2g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,然后加150mL蒸馏水并加入3mL 0.5%淀粉溶液,用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为______。(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-;②(NH4)2Cr2O7的摩尔质量为252g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d 四种短周期元素在周期表中的位置如图所示,a 和 b 分别位于周期表的第 2 列和第 13 列, 下列叙述正确的

A.离子半径 b>d
B.b 可以和强碱溶液发生反应
C.c 的氢化物空间结构为三角锥形
D.a 的最高价氧化物对应水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料.在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH→CO(OCH3)2 + H2O 。某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON ) 的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是
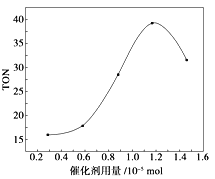
A.由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
B.在反应体系中添加合适的吸水剂,将提高该反应的TON
C.当催化剂用量为1.2×10-5mol时,该反应的TON 达到最高点
D.当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学又称环境友好化学,它的主要特点之一是提高原子的利用率,使原料中所有的原子全部 转化到产品中,实现“零排放”。下列反应符合绿色化学这一特点的是
A. 工业冶炼 Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
B. 用生石灰制熟石灰 CaO+H2O=Ca(OH)2
C. 实验室制取二氧化碳 CaCO3+2HCl=CaCl2+H2O+CO2↑
D. 实验室制取氢气 Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlN新型材料应用前景广泛,其制备与性质研究成为热点。
相关数据如下:
物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
Al | 660 | 2467 | >800 | AlN:>2000 (>1400升华) AlCl3:(>181升华) |
Mg | 649 | 1090 | >300 | Mg3N2:>800 |
(1)AlN的制备。
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是____________________。
Ⅱ.上述反应适宜的温度范围是______℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:__________________、_________和2Al + N2 ![]() 2AlN。
2AlN。
③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) 4Al(g) + 3O2(g) H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:______________________________________。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。
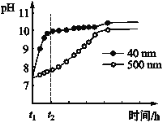
① AlN粉末水解的化学方程式是____________________________________。
② 解释t1-t2时间内两条曲线差异的可能原因:_______________________________。
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 以
以![]() 和
和![]() 为原料合成尿素是利用
为原料合成尿素是利用![]() 的成功范例。在尿素合成塔中的主要反应可表示如下:
的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:![]()
![]()
反应Ⅱ:![]()
![]()
总反应:![]()
![]()
请回答下列问题:
![]() 反应Ⅰ的
反应Ⅰ的![]() ______________。
______________。
![]() 在____
在____![]() 填“高温”或“低温”
填“高温”或“低温”![]() 情况下有利于反应Ⅱ的自发进行。
情况下有利于反应Ⅱ的自发进行。
![]() 氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以
氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以![]() 、
、![]() 、
、![]() 、
、![]() 的形式存在。
的形式存在。

![]() “溶浸”中 ZnO发生反应的离子方程式为 _______。
“溶浸”中 ZnO发生反应的离子方程式为 _______。
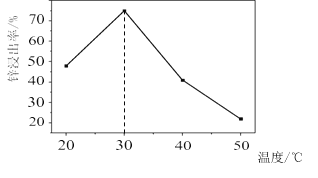
![]() 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析 ![]() 时锌浸出率最高的原因为 __________。
时锌浸出率最高的原因为 __________。
![]() “滤渣 3”的主要成分为_______________。
“滤渣 3”的主要成分为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.2 molNO2与水充分反应,转移电子数为NA
B.含0.1molH3PO4的水溶液中PO43-的数目为0.1NA
C.0.5molNa2O2中O-的数目为NA
D.标况下,42g丙烯和丁烯混合物含C数目为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com