
【题目】下列不能用勒夏特列原理解释的是( )
A.工业合成氨:500℃比室温更有利
B.SO2催化氧化成SO3的反应,往往加入过量的空气
C.对于反应2NO2(g) ![]() N2O4(g),增大压强,体系颜色变浅
N2O4(g),增大压强,体系颜色变浅
D.实验室中常用排饱和食盐水的方法收集氯气
【答案】A
【解析】
A. 合成氨反应为放热反应,升高温度不利用平衡向正方向移动,但主要考虑催化剂的活性和反应速率,与平衡移动无关,不能用勒夏特列原理解释,故A错误;
B. 存在平衡2SO2+O2(g)2SO3(g),加入过量的空气,平衡向正反应方向移动,提高二氧化硫的转化率,能用勒夏特利原理解释,故B正确;
C. 2NO2(g) ![]() N2O4(g),增大压强,反应朝体积减少方向进行,也就是向右进行,二氧化氮体积分数减少,颜色变浅,可以用勒夏特列原理解释,故C正确;
N2O4(g),增大压强,反应朝体积减少方向进行,也就是向右进行,二氧化氮体积分数减少,颜色变浅,可以用勒夏特列原理解释,故C正确;
D. 氯水中存在平衡Cl2+H2OHCl+HClO,饱和氯化钠中氯离子浓度较大,平衡左移,可抑制氯气的溶解,可用勒夏特列原理解释,故D正确;
故选A。


科目:高中化学 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。

下列推断不正确的是
A. 无色溶液B的pH≥7
B. 白色固体F的主要成分是H2SiO3
C. 混合物A中有Na2SiO3、CuSO4和CaCO3
D. 在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室按如下装置测定纯碱(含少量 NaCl)的纯度。下列说法错误的是
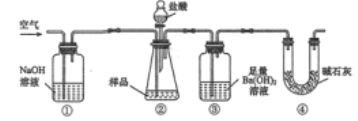
A. 实验前, 应进行气密性检查
B. 必须在装置②、 ③间添加吸收 HCl 气体的装置
C. 装置④的作用是防止空气中的 CO2进入装置③与 Ba(OH)2 溶液反应
D. 反应结束时,应再通入空气将装置②中产生的气体完全转移到装置③中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。
![]()
已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
Ⅱ.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是______________。
(2)吸收塔中的原料B可以选用_____________(填字母序号)。
A.NaCl溶液 B.Na2CO3溶液 C.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3的过程(加热装置已略去)。
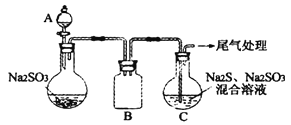
①A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是_____________。装置B的作用是______________。
②C中制备Na2S2O3发生的连续反应有:Na2S+H2O+SO2=Na2SO3+H2S_____________和Na2SO3+S![]() Na2S2O3 。
Na2S2O3 。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体D是一种红色氧化物。

(1)混合气体A通入足量NaOH溶液后,溶液B中属于盐的溶质有___________________。
(2)白色沉淀C中加入盐酸的实验现象为____________________________________。
(3)固体D与HCl溶液反应的离子方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应 X2(g)+Y2(g) ![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能为
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能为
A. Y2为0.4mol/LB. Z为0.3mol/L
C. X2为0.2mol/LD. Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答问题:
(1)Deacon发明的直接氧化法为:4HCl(g) + O2(g) ![]() 2Cl2(g) +2H2O(g)。如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:可知反应平衡常数K(300℃)_________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比的数据计算c(HCl):c(O2) = 1:1的数据计算K(400℃)=________________(列出计算式即可)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2) 过低、过高的不利影响分别___________________________、____________________________。
2Cl2(g) +2H2O(g)。如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:可知反应平衡常数K(300℃)_________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比的数据计算c(HCl):c(O2) = 1:1的数据计算K(400℃)=________________(列出计算式即可)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2) 过低、过高的不利影响分别___________________________、____________________________。
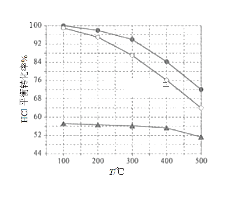
(2)在一定温度的条件下,进一步提高HCl的转化率的方法是__________________________、___________________________________。(写出2种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用图示装置制备高铁酸钾(K2FeO4)并探究其性质。已知:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。制取实验完成后,取C中紫色溶液,加入稀盐酸,产生气体。下列说法不正确的是

A.B瓶应盛放饱和食盐水除去混有的HCl
B.C瓶中KOH过量更有利于高铁酸钾的生成
C.加盐酸产生气体可说明氧化性:K2FeO4>Cl2
D.高铁酸钾是集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等八大特点为一体的优良的水处理剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置用环己醇制备环己烯,装置如图1所示。

已知: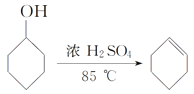 +H2O。
+H2O。
密度/ g·cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①试管A中碎瓷片的作用是___,导管B除了导气外还具有的作用是__。
②将试管C置于冰水中的目的是__。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在___(填“上”或“下”)层,分液后用___(填字母)洗涤。
a.酸性KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将提纯后的环己烯按如图2所示装置进行蒸馏,冷却水从__(填字母)口进入,目的是___。蒸馏时要加入生石灰,目的是___。

③收集产品时,应控制温度在___左右,实验制得的环己烯精品质量低于理论产量,可能的原因是___(填字母)。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗产品时环己醇随产品一起蒸出
(3)以下用来区分环己烯精品和粗品的试剂或方法中,合理的是__(填字母)。
a.酸性高锰酸钾溶液 b.金属钠 c.测定沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com