
【题目】某化学小组采用类似制乙酸乙酯的装置用环己醇制备环己烯,装置如图1所示。

已知: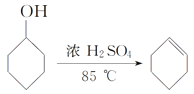 +H2O。
+H2O。
密度/ g·cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①试管A中碎瓷片的作用是___,导管B除了导气外还具有的作用是__。
②将试管C置于冰水中的目的是__。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在___(填“上”或“下”)层,分液后用___(填字母)洗涤。
a.酸性KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将提纯后的环己烯按如图2所示装置进行蒸馏,冷却水从__(填字母)口进入,目的是___。蒸馏时要加入生石灰,目的是___。

③收集产品时,应控制温度在___左右,实验制得的环己烯精品质量低于理论产量,可能的原因是___(填字母)。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗产品时环己醇随产品一起蒸出
(3)以下用来区分环己烯精品和粗品的试剂或方法中,合理的是__(填字母)。
a.酸性高锰酸钾溶液 b.金属钠 c.测定沸点
【答案】防暴沸 冷凝 防止环己烯挥发 上 c g 冷却水与气体形成逆流,使气体得到充分冷却 吸收剩余的水 83℃ c bc
【解析】
(1)①将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后为了防止暴沸,向试管中放入碎瓷片,导管较长,除了导气还可起到冷凝作用;
②反应后生成的环己烯为气态,易挥发,为了收集环己烯,将试管置于冰水中,可防止环己烯挥发;
(2)①根据表格中的密度确定环己烯的位置,生成的环己烯中还存在少量的酸,可用Na2CO3溶液吸收;
②蒸馏操作中冷却水进出水方向为“下进上出”;
③根据环己烯的沸点判断;
a.若提前收集,产品中会混有杂质;
b.制取的环己烯物质的量增大;
c.粗产品中混有环己醇,导致测定消耗的环己醇量增大;
(3)根据混合物没有固定的沸点,而纯净物有固定的沸点进行判断。
(1)①试管中加入碎瓷片是为了防止暴沸,导管较长,除了导气还可起到冷凝作用;
②反应后将试管置于冰水中,可防止环己烯挥发;
(2)①根据表格中的密度数据可知,环己烯的密度小于环己醇的密度,因此加入饱和食盐水,振荡、静置、分层,环己烯在上层;生成的环己烯中还存在少量的酸,可用Na2CO3溶液吸收;
②蒸馏操作中冷却水进出水方向为“下进上出”,即冷却水从g口进入,这时候冷却水与气体形成逆流,使气体得到充分冷却;
③环己烯的沸点是83℃,因此收集产品时,应控制温度在83℃左右;
a.若提前收集,产品中会混有杂质,实际产量高于理论产量;
b.制取的环己烯物质的量增大,实际产量高于理论产量;
c.粗产品中混有环己醇,导致测定消耗的环己醇量增大,制得的环己烯实际产量低于理论产量;
因此实验制得的环己烯精品质量低于理论产量,可能的原因是c;
(3)区分环己烯精品和粗品可加入金属钠,观察是否有气体生成,如有气体是粗品,如没有气体是精品;此外,还可以根据混合物没有固定的沸点,而纯净物有固定的沸点进行判断。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的是( )
A.工业合成氨:500℃比室温更有利
B.SO2催化氧化成SO3的反应,往往加入过量的空气
C.对于反应2NO2(g) ![]() N2O4(g),增大压强,体系颜色变浅
N2O4(g),增大压强,体系颜色变浅
D.实验室中常用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的现象不符合事实的是
选项 | 实验操作 | 现象 |
A | 向盛有 | 溶液逐渐变为黄色,滴加KSCN后溶液变血红色 |
B | 向盛有 | 溶液逐渐褪色,静置后观察到溶液有分层现象 |
C | 向 | 先产生白色沉淀,后沉淀消失 |
D | 向盛有 | 有刺激性气味气体产生,溶液变浑浊 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种常用的还原剂、媒染剂。某化学小组同学在实验室里用如下两种方法来制备无水
是一种常用的还原剂、媒染剂。某化学小组同学在实验室里用如下两种方法来制备无水![]() 。有关物质的性质如下:
。有关物质的性质如下:
|
|
|
| |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于 | ||
熔点 |
| 53 | 易升华 | |
沸点 | 132 | 173 |
|
|
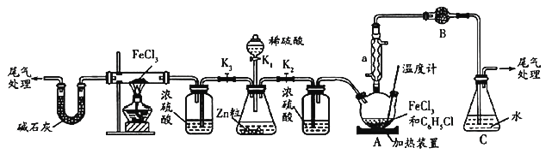
请回答下列问题:
(1)利用反应![]() 制取无水
制取无水![]() 并测定
并测定![]() 的转化率。按上图装置,在三颈烧瓶中放入
的转化率。按上图装置,在三颈烧瓶中放入![]() 无水氯化铁和过量的氯苯。打开
无水氯化铁和过量的氯苯。打开![]() 、
、![]() ,关闭
,关闭![]() ,通一段时间
,通一段时间![]() 后关闭
后关闭![]() ,控制三颈烧瓶内反应温度在
,控制三颈烧瓶内反应温度在![]() ,反应一段时间。反应完成后打开
,反应一段时间。反应完成后打开![]() 再通氢气一段时间。
再通氢气一段时间。
①仪器a的名称是_________,装置B中盛装的试剂是____________。
②反应后再通入![]() 的目的是________。
的目的是________。
③冷却实验装置,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,回收滤液中![]() 的操作方法是________。
的操作方法是________。
(2)打开![]() 、
、![]() ,关闭
,关闭![]() ,通氢气与氯化铁反应制取无水
,通氢气与氯化铁反应制取无水![]() 。
。
①写出反应的化学方程式_____________。
②实验制得![]() 后并防止氧化的操作是_______。
后并防止氧化的操作是_______。
③请指出该制备方法的缺点________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用药品柳胺酚的合成路线如图。

已知:①![]() ;
;
②![]() (R代表烷基)
(R代表烷基)![]() ;
;
③当苯环上连有羧基,在苯环上引进的新取代基易进入羧基的间位。
回答下列问题:
(1)柳胺酚的分子式为__,F含有的官能团名称是__。
(2)A的名称为____。
(3)A→B所需试剂为___;D→E的反应类型为___。
(4)B→C的化学方程式为___。
(5)F的同分异构体中既能与FeCl3溶液发生显色反应,又能发生银镜反应的共有__种,其中能发生水解反应,核磁共振氢谱显示4组峰,其峰面积之比为1∶2∶2∶1的同分异构体的结构简式是___。
(6)写出以甲苯为原料(其他无机试剂任选)制备高聚物 的合成路线。__。
的合成路线。__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L四氯化碳中含有共价键总数为0.4NA
B.46g NO2和N2O4的混合气体中,含有的氮原子数为1NA
C.1L1.0mol/L的盐酸中含有HCl分子数为NA
D.一定条件下,将2molSO2与1molO2充分反应,得到SO3的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法不正确的是( )

A.元素甲的原子结构示意图为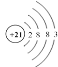
B.原子半径比较:甲>乙>Si
C.元素乙的简单气态氢化物的稳定性比CH4弱
D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两种烃,已知A的分子式为C5Hm,而B的最简式为C5Hn(m、n均为正整数)。
(1)下列关于烃A和烃B的说法中不正确的是_____(填字母编号)。
a、烃A和烃B可能互为同系物
b、烃A和烃B可能互为同分异构体
c、当m=12时,烃A一定为烷烃
d、当n=11时,烃B可能的分子式有两种
e、烃A和烃B可能都为芳香烃
(2)若烃A为链状烃,且分子中所有碳原子都在一条直线上,则A的结构简式为____。
(3)若烃A为链状烃,分子中所有碳原子不可能都在同一平面上。在一定条件下,1mol A最多只能与1mol H2发生加成反应。写出烃A的名称:_______。
(4)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量浓硫酸,浓硫酸增重1.26g,再通过足量碱石灰,碱石灰增重4.4g,则烃B的分子式为______。
(5)有机物CH3CH(C2H5)CH(CH3)(CH2)3 CH3的系统命名是_______,1mol该有机物完全燃烧需消耗标准状况下氧气___L。
(6)请写出下列化合物所含官能团的名称:
①CH3CH=CH2:______; ②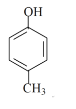 :______; ③
:______; ③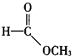 :______。
:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com