
【题目】硼、铝属元素周期表IIIA短周期元素。回答下列问题:
(1)基态B原子的价电子轨道表达式为__________,其第一电离能比Be ________(填“大”或“小”)。
(2)氨硼烷(NH3BH3)是最具潜力的储氢材料之一,分子中存在配位键,能体现配位键的结构式为__________,与氨硼烷互为等电子体的烃的分子式为__________。
(3)插图 | (4)插图 | (5)插图 |
(3)常温常压下硼酸晶体为结构层状,其二维平面结构如图所示:
硼酸的化学式为__________,B原子的杂化类型为_______。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:_____________________________________。
(4)8-羟基喹啉铝是一种黄色粉末,它是OLED中的重要发光材料及电子传输材料,其微观结构如图所示,8-羟基喹啉铝中存在的化学键为______________。
A.金属键 B.极性键 C.非极性键 D.配位键 E.π键
(5)金属铝晶体中原子呈面心立方紧密堆积(如上图)。该晶胞空间利用率为_________________(用含π的代数式表示);铝的密度是2.7gcm-3,阿伏伽德罗常数为NA,依此可计算出Al原子半径r(Al)=__________cm.
【答案】 ![]() 小
小 ![]() C2H6 H3BO3 sp2 氢键使硼酸“缔合”成层状“大分子”,故不易溶于水;加热破坏了氢键使“大分子”解离,溶解度增大 BCDE
C2H6 H3BO3 sp2 氢键使硼酸“缔合”成层状“大分子”,故不易溶于水;加热破坏了氢键使“大分子”解离,溶解度增大 BCDE ![]()
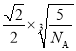
【解析】(1). B原子的价电子分布为2S2SP1,其电子排布图为![]() ,在一个轨道中,最多仅能容纳2个电子,它们的自旋状态相反,用↑↓表示;根据“洪特规则”,等价轨道全满为稳定结构,所以B的第一电离能小于Be。
,在一个轨道中,最多仅能容纳2个电子,它们的自旋状态相反,用↑↓表示;根据“洪特规则”,等价轨道全满为稳定结构,所以B的第一电离能小于Be。
(2)NH3与BH3均为0化合价,NH3给出孤对电子, BH3提供空轨道接受电子对形成了![]() 结构;很明显,乙烷C2H6与氨硼烷互为等电子体;
结构;很明显,乙烷C2H6与氨硼烷互为等电子体;
(3)每个单元中B为2/3,O为2,H为2,故分子式为H3BO3;B与3个O原子杂化得到三个夹角为120°的平面三角形杂化轨道,为sp2杂化;加热时,硼酸分子间氢键断裂,所以硼酸在冷水中的溶解度小而加热时溶解度增大;
(4)A. 金属键主要存在于金属晶体中,所以此结构中不存在金属键,A错误;B. 结构中H原子与其他原子形成的共价键为极性键,B正确;C. 碳原子间形成的共价键为非极性键,C正确;D. 铝具有空轨道与N(具有孤对电子)形成配位键,D正确;E. 因为苯环中含有π键,所以8-羟基喹啉铝中含有π键,E正确。故选择BCDE。
(5)在面心立方最密堆积的晶胞中,面对角线长度是原子半径的4倍。则晶胞边长为2![]() r ,晶胞体积V晶胞=16
r ,晶胞体积V晶胞=16![]() 。面心立方堆积的晶胞上占有的原子数为8×
。面心立方堆积的晶胞上占有的原子数为8×![]() +6×
+6×![]() =4,原子占有的体积为V原子 = 4×
=4,原子占有的体积为V原子 = 4×![]() πr3 。晶胞的空间利用率等于V原子/V晶胞 =
πr3 。晶胞的空间利用率等于V原子/V晶胞 =![]() =
= ![]() .
.


科目:高中化学 来源: 题型:
【题目】α1和α2、c1和c2分别为两个恒容容器中平衡体系N2O4(g)![]() 2NO2(g)和3O2(g)
2NO2(g)和3O2(g)![]() 2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量。下列判断正确的是
2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量。下列判断正确的是
A. α1减小,α2增大,c1、c2均增大 B. α1、α2均增大,c1、c2均增大
C. α1增大,α2减小,c1、c2均增大 D. α1减小,α2增大,c1增大,c2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学的实验方法是探索物质世界的一把金钥匙,下列实验方法或操作正确的是( )
A.观察钾元素焰色反应的操作:先将铂丝放在稀硫酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的外焰上进行灼烧,透过蓝色钴玻璃进行观察
B.因为碘易溶于酒精,所以常用酒精萃取碘水中的碘
C.两种互不相溶的液体,如汽油和水,可通过分液方法分离
D.用丁达尔效应鉴别 NaCl 溶液和 KCl 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程,属于吸热反应的是( )
①铝热反应 ②酸碱中和 ③浓H2SO4稀释 ④固体氢氧化钠溶于水
⑤H2在Cl2中燃烧 ⑥液态水变成水蒸气 ⑦NH4Cl晶体与Ba(OH)28H2O混合搅拌⑧工业制取水煤气.
A. ①②③④⑤ B. ①②⑤ C. ⑦⑧ D. ⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,溶液里无固体析出的是( )
A.MgCl2溶液中加入Na的小颗粒B.饱和Ca(OH)2溶液中加入Na的小颗粒
C.CuSO4溶液中加入Na的小颗粒D.水中加入Na的小颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制备二氧化硫

若使用上图所示装置制备干燥的SO2气体,回答以下问题:
①A中盛液体的玻璃仪器名称是____________,实验开始后A中反应的化学方程式为______________________________________________________。
②B装置的作用是_______________________;C装置的作用____________________。
③E中固体试剂为________________。
(2)制备保险粉
如下图,维持35~45℃通SO2至锌粉-水悬浮液反应生成ZnS2O4;然后加入18%的氢氧化钠溶液,在28~35℃下反应生成Na2S2O4和Zn(OH)2悬浮液。

反应物经压滤除去氢氧化锌沉淀后,往滤液中加入氯化钠,并冷却至20℃,使Na2S2O4结晶析出,滤出晶体后用酒精脱水干燥即得产品。
①在制取Na2S2O4过程中发生了氧化还原反应,氧化剂是___________;生成1mol Na2S2O4转移电子______mol。
②滤液中加入氯化钠使_______离子浓度增大,促进Na2S2O4结晶析出;滤出晶体后用酒精脱水干燥是因为Na2S2O4在酒精中的溶解度_______(填“较大”或“较小”),且酒精易挥发。
③制取Na2S2O4也常用甲酸钠法,控制温度70~80℃,在甲醇溶液(溶剂)中溶解甲酸钠(HCOONa),再滴加Na2CO3溶液同时通SO2维持溶液微酸性,即可生成Na2S2O4,反应的离子方程式:_________________________________________。
(3)测定保险粉纯度
Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4 + 6KMnO4 + 4H2SO4 = 5Na2SO4 + 3K2SO4 + 6MnSO4 + 4H2O
称取3.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于试管中,用0.10mol·L-1的KMnO4溶液滴定。
重复上述操作2次,平均消耗KMnO4溶液18.00 mL则该样品中Na2S2O4的质量分数为_____________(杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 南海开采出的可燃冰属于新能源
B. 任何化学反应中的能量变化都表现为热量变化
C. 有化学键断裂不一定发生化学反应
D. 吸热反应只有加热才能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是
A. 强电解质在水溶液中的电离过程是不可逆的
B. CO2的水溶液能导电,所以CO2是电解质
C. 碳酸钙在水里的溶解度很小,所以碳酸钙是弱电解质
D. 强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。有如下的A~G请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,实验测得A的pH<7,原因是(用离子方程式表示): ;在该溶液中各种离子浓度由大到小的顺序为_______________。
(2)B为0.1 mol·L-1 NaHCO3溶液,实验测得B的pH>7,请分析B显碱性的原因: ____________________。
(3)C为Al2(SO4)3溶液,把C蒸干,灼烧,最后得到的固体产物是 。若把B和C混合,将产生白色沉淀和无色气体,该反应的离子方程式为__________________。
(4)D为CH3COONa溶液,常温下,pH=9的D中,水电离出来的c(OH-)=________。
(5)E为某浓度的NH4Cl溶液,常温下, 测得该溶液的pH=5,写出该溶液中下列算式的精确结果(列式):c(Cl-)-c(NH4+)=_____________ mol/L。
(6)F为Mg(OH)2溶液,求室温下F饱和溶液中Mg2+的物质的量浓度=____________ mol/L(已知室温时,Mg(OH)2的溶度积Ksp=3.2×10-11)。
(7)G为硫化钠溶液,在配制G时,为了防止发生水解,可以加入少量的 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com