
【题目】下列实验操作中,溶液里无固体析出的是( )
A.MgCl2溶液中加入Na的小颗粒B.饱和Ca(OH)2溶液中加入Na的小颗粒
C.CuSO4溶液中加入Na的小颗粒D.水中加入Na的小颗粒
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如下图所示,室温下向盛有3.0 mL NO的试管中缓缓通入1.5 mL O2(所有气体体积均在标准状况下测定)。

试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①___________;
②___________;
③___________。
(2)最终试管中剩余的气体是______,体积为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为了回收利用含钢催化剂(V2O5、VOSO4及不溶性杂质),科研人员最新研制了一种离子交换法回收钒的新工艺。该工艺的主要流程如图所示:

已知:部分含钒物质在水中的溶解性:
物质 | V2O5 | VOSO4 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 可溶 | 难溶 | 易溶 |
(1)由V2O5冶炼金属钒采用铝热剂法,反应的化学方程式为:___________
(2)V2O5通常用作为反应2SO2+O2![]() 2SO3的理想催化剂,其催化的机理可能是加热时可逆地失去氧的原因,其过程可用两个化学方程式表示:_________、4V+5O2
2SO3的理想催化剂,其催化的机理可能是加热时可逆地失去氧的原因,其过程可用两个化学方程式表示:_________、4V+5O2![]() 2V2O5.
2V2O5.
(3)反应①的目的是_________.
(4)将滤液1与滤液2混合后用氯酸钾氧化,氯元素被还原为最低价,其反应的离子方程式为______.
(5)反应③的沉淀率(又称沉钒率) 是回收钒的关键之一,下图是反应温度与沉钒率的关系图,则控制温度的方法是____________.

(6)反应④在NH4VO3的焙烧过程中,固体质量的减少值(纵坐标) 随温度变化的曲线如图2所示,则其分解过程中_______(填字母代号)。

A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3, 再分解失去H2O
C.同时分解失去H2O 和NH3
D.同时分解失去H2和N2和H2O
(7)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+![]() VO2++H2O+V3+。电池充电时阳极的电极反应式为__________
VO2++H2O+V3+。电池充电时阳极的电极反应式为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于amolH2O和amolCO2的说法正确的是( )
A.相同条件下体积一定相同
B.氧原子个数一定相同
C.分子个数一定相同
D.质量比是22:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X和Y的转化率相等
D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、铝属元素周期表IIIA短周期元素。回答下列问题:
(1)基态B原子的价电子轨道表达式为__________,其第一电离能比Be ________(填“大”或“小”)。
(2)氨硼烷(NH3BH3)是最具潜力的储氢材料之一,分子中存在配位键,能体现配位键的结构式为__________,与氨硼烷互为等电子体的烃的分子式为__________。
(3)插图 | (4)插图 | (5)插图 |
(3)常温常压下硼酸晶体为结构层状,其二维平面结构如图所示:
硼酸的化学式为__________,B原子的杂化类型为_______。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:_____________________________________。
(4)8-羟基喹啉铝是一种黄色粉末,它是OLED中的重要发光材料及电子传输材料,其微观结构如图所示,8-羟基喹啉铝中存在的化学键为______________。
A.金属键 B.极性键 C.非极性键 D.配位键 E.π键
(5)金属铝晶体中原子呈面心立方紧密堆积(如上图)。该晶胞空间利用率为_________________(用含π的代数式表示);铝的密度是2.7gcm-3,阿伏伽德罗常数为NA,依此可计算出Al原子半径r(Al)=__________cm.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是石蜡油在炽热碎瓷片的作用下产生乙烯,并检验乙烯性质的实验。
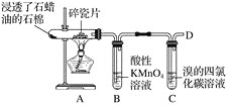
回答下列问题:
(1)从装置A中出来的气体中含有烷烃和________。
(2)B中酸性高锰酸钾溶液________,这是因为生成的气体被________(填“氧化”或“还原”),反应类型为________。
(3)C中溴的四氯化碳溶液________,发生反应的化学方程式:____________,反应类型为________。
(4)在D处点燃之前必须进行的操作是__________,燃烧时反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在400℃、101 kPa时,NO2(g) +CO(g) ![]() NO(g) + CO2(g) 反应过程的能量变化如下图所示。
NO(g) + CO2(g) 反应过程的能量变化如下图所示。

反应过程
(1)该反应是_____________(填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为_____________。
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是_____________。
a.浓度 b.压强 c.温度 d.催化剂
(4)反应体系中加入催化剂对反应热是否有影响?____(填“是”或“否”),原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的体积主要由什么因素决定的( )
①气体分子的大小 ②气体分子数的多少 ③气体分子间的平均距离④气体分子的相对分子质量.
A.①②B.①③C.②③D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com